转自:生信菜鸟团(微信公众号)| 作者:大土豆力
自2012年首次报道circRNA是一类独立且具有转录后调控能力的非编码RNA以来,积累了大量的研究报道。前期我们已根据两篇权威综述梳理了circRNA的生物合成及功能,circRNA由于特殊的拓扑结构能够抵抗核酸外切酶的降解,因此具有较长的半衰期,具有作为病理生物标记物的潜力。
阅读综述总能帮助我拓宽这个领域的视野,顺着文献查漏补缺吧~
circRNA表达特征
circRNA表达具有组织特异性,根据报道,circRNA在不同人类组织中的表达情况如下:大脑中20%的基因能够产生circRNA;心脏中9%;白细胞中10%;成纤维细胞14%。在人类和小鼠实验中发现,circRNA能够富集于神经系统中,可能是由于神经细胞的分裂速度较慢而导致的被动积累,同理可推,增殖中的癌细胞中circRNA的表达水平将低于高度分化的细胞。
大多数的circRNA的表达水平只有其线性转录本的5~10%,但是也有特例。尽管效率较低,但是较长的半衰期也能使得一些circRNA累积到相对高的水平。
一些研究表明,circRNA的表达受到年龄相关、疾病以及内环境变化 (如激素水平、氧化应激(Oxidative Stress,OS)或者高温) 的影响,但是导致这种调控的原因尚不清楚,因为circRNA的来源基因的表达并没有增加。
circRNA合成机制
这里作者描述了三种已知的调控机制:
1、内含子驱动的互补配对
intronic complementary sequences (ICSs),Alu repeats
2、RNA结合蛋白 (RBP)驱动的环化
quaking、muscleblind-like protein 1 (MBNL1)、RNA-binding protein 20 (RBM20), the interleukin enhancer-binding factor 3 and serine/ arginine-rich splicing factors (for example, SRSF1, SRSF6 and SRSF11)
3、套索驱动的环化
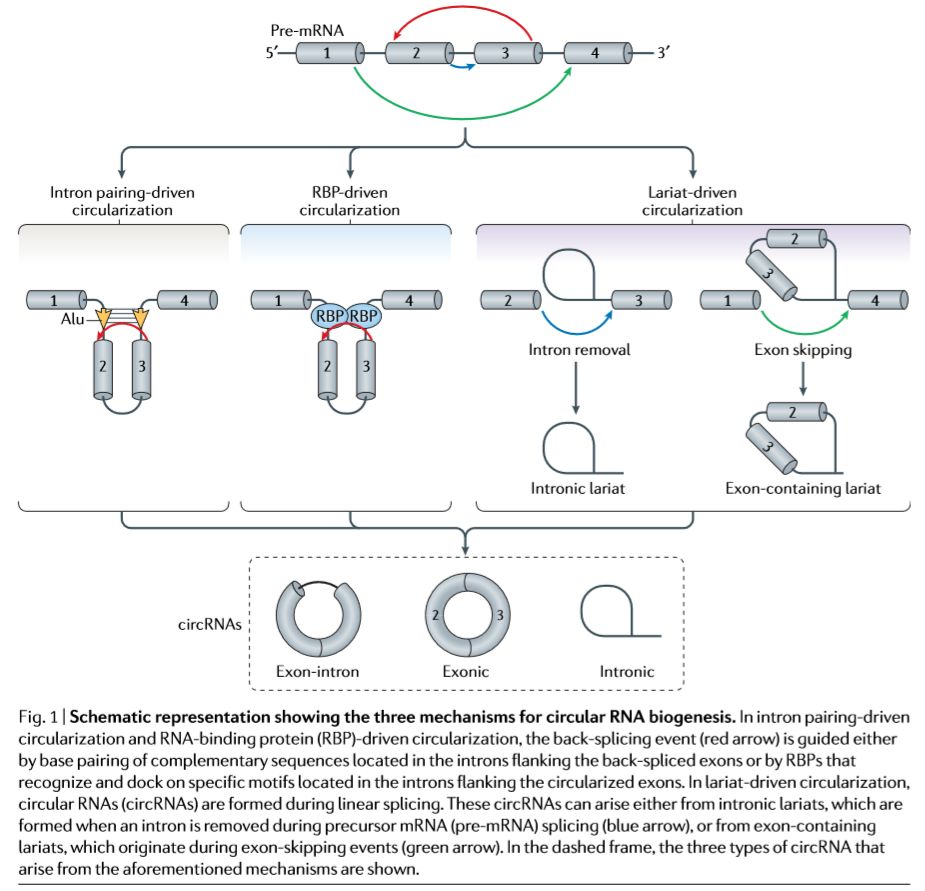
circRNA来源于mRNA前体的可变剪切,不仅受到RNA聚合酶II的介导,同时受到顺式作用元件(上述第一种)、反式作用因子的调控(上述第二种)。第三种由外显子跳跃事件形成套索驱动的环化并不常见,但是心脏中编码titin的TTN基因是circRNA的重要来源,虽然目前尚不了结这种发生模式为何与其他的circRNA形成机制不同。证据显示,RNA编辑酶ADAR能够通过作用于由反向剪切的外显子和侧翼 (bracketing) 内含子元件配对形成的双链RNA,抑止circRNA的形成,说明RNA修饰同样能够调控circRNA的发生。
circRNA的研究方法
生物信息学
在我们前期的笔记中已经分享了circRNA算法基于的原理:
1、split-alignment-based approaches:针对内含子驱动模式下的反向可变剪切接头序列(back-spliced junction)设计的预测软件,如 find_circ、CIRCexplorer、CIRI和 MapSplice等;
2、pseudoreference-based approaches:通过基因组注释信息推测得到反向可变剪切接头序列,然后与注释的外显子序列进行匹配,预测得到新 circRNA的软件,如 KNIFE、 NCLscan等。
在这里,作者总结了第三类不依赖参考基因组上mapping片段的方法:k-mer based。在这种方法中,将只提取于外显子边界内的短序列片段成为 k-mers (k-mers of <16 nt),并分析是否存在无序的读段 (out-of-order k-mers)。从下图c中图显示,个人理解与图a中的确定候选circRNA的方法是相似的。目前,以该种原理鉴定的程序仅有CircMarker,依赖注释,有兴趣的小伙伴可以翻看一下源代码,地址如下:
https://github.com/lxwgcool/CircMarker。
实验验证
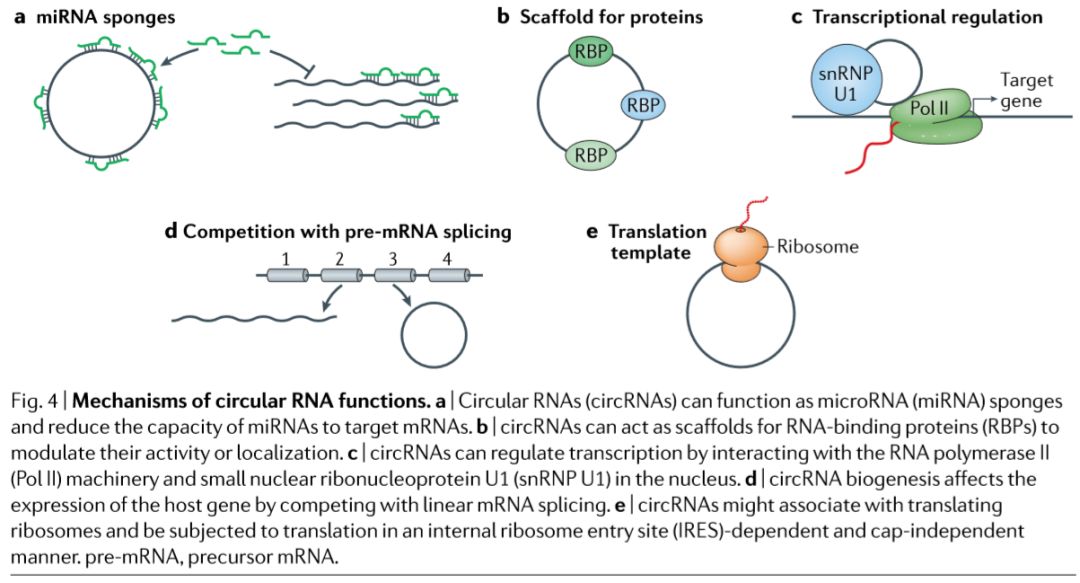
大致有以下几个方面:
1、MicroRNA sponges
2、Scaffolds for proteins
3、Transcriptional regulators
4、Competitors of linear splicing
5、Templates for protein synthesis
具体内容将单独归于一个板块来写,敬请期待。功能模式图如下:
circRNA在心血管
2016年,首个小鼠心脏的circRNA表达谱鉴定到了575个circRNA,后续比较人类心脏的circRNA发现,这些circRNA的序列保守性较差。同时,作者综述了几篇circRNA与疾病相关的心脏circRNA表达报道,包括非缺血性晚期心力衰竭、心脏肥大、糖尿病心肌研究 (Table 2)。

在心血管系统中,生物学功能研究报道总结于下表中 (Table 3)。详细内容可以翻查参考文献了解。
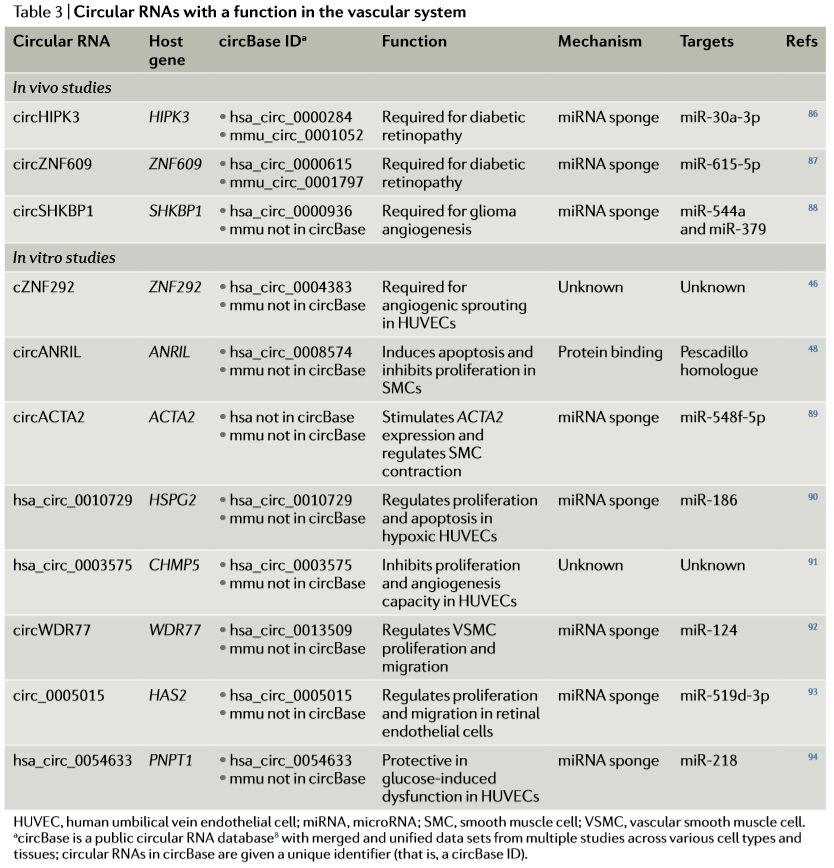
这些报道的circRNA能够通过miRNA海绵方式参与疾病发病过程,一些circRNA能够以外泌体的方式进入血液或者唾液中,具有作为预后生物学标记的潜力。
小结
体液中的circRNA有望作为各种疾病的新型标记物,具有预后及治疗意义。比如对靶向miRNA设计人工circRNA分子进行干预,亦或是通过IRES序列,启动circRNA载体的表达都具有很大的应用前景。当然,这些工作仍处于起步阶段,检测circRNA的技术和生物信息学方法也同样需要标准化。
参考文献:Aufiero S, Reckman Y J, Pinto Y M, et al. Circular RNAs open a new chapter in cardiovascular biology[J]. Nature Reviews Cardiology, 2019: 1.





来第一个抢占沙发评论吧!