本文刊于:中华心血管病杂志,2020,48(1): 81-85
作者:袁朝汉 伍贵富
单位:广东医科大学 |中山大学附属第八医院
摘要
环状RNA是一种闭合的环状结构RNA,绝大多数具有物种间的高度保守性,又具有细胞与组织特异性,与细胞的生长、增殖和凋亡关系密切。研究发现环状RNA对很多心血管疾病的发生、发展有重要的调控作用。该文从环状RNA的形成、调控机制,及其与动脉粥样硬化、心肌梗死、心肌肥厚、肺动脉高压、心房颤动等心血管疾病的关系做一综述。
1976年德国科学家在植物中首次发现环状RNA,其呈闭合环状结构,不含5’端和3’端,不易被RNA酶降解,具有很好的物种间保守性。既往认为人类的环状RNA由于没有核糖体进入位点,无法通过翻译蛋白质参与重要的生命活动,属于长链非编码RNA,并且可能是基因转录水平剪切过程发生剪接错误形成的产物[1,2,3,4]。近年来越来越多的研究表明环状RNA在基因的表达调控方便发挥着重要作用,与肿瘤、神经性疾病、心血管疾病等发生密切相关,不仅如此,研究还发现部分环状RNA具有翻译蛋白质的功能[5,6,7]。在心血管疾病方面,研究发现环状RNA与动脉粥样硬化、心肌梗死、心肌肥厚、心肌纤维化、心脏衰老等密切相关,此外近期研究还发现环状RNA与肺动脉高压、腹主动脉瘤、心房颤动(房颤)等也有一定关系。环状RNA具有保守性与稳定性,是一种理想的生物学标志物,很多环状RNA作为疾病诊断的潜在标志物正逐渐被挖掘出来。
一、环状RNA的形成和调控机制
1.环状RNA的形成:
环状RNA根据DNA序列的来源可主要分为3类,即外显子环状RNA(exoniccircRNA,ecircRNA)、内含子环状RNA(intronic circRNA,ciRNA)和内含子-外显子环状RNA(exon-intron circRNA,EIciRNA)。环状RNA最常分布于细胞质中,除了线粒体,环状RNA广泛分布于各种亚细胞结构。由于ciRNA转录剪接后易降解,该类环状RNA主要分布于细胞核中,只有极少数在细胞质中以圆形(套索)分子存在,大多数长度为100~500个核苷酸,并且衍生自许多管家基因[8]。环状RNA可以通过外泌体运输,可以出细胞膜进入血浆,广泛分布于人体的组织和器官,具有细胞和组织特异性[2,6,9,10,11]。目前研究认为大多数环状RNA来自外显子来源的前体mRNA反向剪接,下游5’剪接位点与上游3’端以磷酸二酯键结合,形成闭合的环状单链RNA[12]。内含子来源的套索结构,由两个末端之间独特的2′-5’连接,在修剪尾部后,可形成ciRNA。此外,前体tRNA也可通过剪接形成环状RNA与tRNA。在环状RNA形成过程中,反向互补序列和RNA结合蛋白发挥了重要作用[13,14,15]。
2.环状RNA的调控机制:
环状RNA的主要调控机制包括:
(1)调节线性RNA的转录。
(2)发挥海绵吸附微小RNA(microRNA,miRNA)作用,从而影响miRNA靶基因的表达。例如反义小脑变性相关蛋白1转录物(cerebellar degeneration-related protein 1 transcript,CDR1as),作为一种在大脑中表达很高的环状RNA,可以起到海绵吸miRNA-7的作用,从而调节miRNA-7的靶基因表达[15,16]。
(3)作为蛋白质结合骨架。例如在苍蝇和人类中发现的环状肌肉蛋白(muscle blind protein,MBL)RNA可以在多个结合位点与MBL结合,起到蛋白质骨架的作用。
(4)与蛋白质相互作用从而影响蛋白质功能。例如来源于叉型头转录因子O亚型3基因的环状RNA(circular RNA forkhead box O3,circ-FOXO3),一种目前受到关注最多的环状RNA,研究证明其可作为桥接p21和细胞周期蛋白依赖性激酶2的调节因子,可以通过增强与抗衰老蛋白ID-1和转录因子E2F1以及抗应激蛋白-粘着斑激酶(focal adhesion kinase,FAK)和缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF1α)的作用促进心脏衰老[17]。
(5)翻译蛋白质发挥生物作用[10]。例如环状RNA_ZNF609、环状RNA_Mbl等[12]。
二、环状RNA与心肌的疾病
1.环状RNA与心肌梗死:
最近,一种与小脑变性相关蛋白1转录物反义的人类环状RNA——CDR1as,也被称为海绵miRNA-7环状RNA(circular CDR1 antisense,ciRS-7),已证实其可与miRNA-7共享表达域[18]。结扎前降支建立的小鼠心肌梗死模型及体外低氧处理的心肌细胞的实验研究均发现Cdr1as和miRNA-7a表达上调。miRNA-7a可使聚腺苷二磷酸-核糖聚合酶(polyadenosine diphosphate-ribose polymerase,PARP)和特异性蛋白1(specific protein 1,SP1)表达下调从而保护损伤心肌,而Cdr1as则起到海绵吸附miRNA-7a的作用,抑制miRNA-7a的下游靶标PARP和SP1的表达,从而促进心肌细胞凋亡[19]。环状RNA_钠/钙交换蛋白-1(sodium/calcium exchange protein-1,NCX1)转录自钠/钙交换蛋白-1基因第2个外显子,主要分布于细胞质中,可在心肌细胞中表达。在缺氧诱导的心肌损伤模型中,环状RNA_NCX1的表达增加,环状RNA_NCX1可通过与miRNA-133a-3p结合起到海绵吸附作用,使miRNA-133a-3p的靶基因——细胞死亡诱导蛋白(cell death-inducing protein,CDIP1)基因的表达上调,从而促进细胞凋亡[20]。线粒体裂变和凋亡相关的环状RNA(mitochondrial fission and apoptosis-related circRNA,MFACR)是衍生自SET的外显子5和含有MYND结构域的4(Smyd4)基因的剪接,线粒体膜蛋白18(mitochondrial membrane protein 18,MTP18)是一种核编码的线粒体膜蛋白,据报道该蛋白在哺乳动物细胞中有助于线粒体裂变[21]。有研究表明MFACR通过靶向miRNA-652-3p依赖性MTP18激活和引起线粒体裂变,介导心肌细胞凋亡和心肌梗死。MFACR/miRNA-652-3p/MTP18轴作为心肌细胞凋亡的调节因子,可能是未来心血管疾病潜在的治疗靶点[18,22]。
2.环状RNA与心肌肥厚:
研究发现部分非编码RNA与心肌肥厚密切相关,研究较多的是miRNA,其主要通过磷脂酰肌醇-3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)、丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)、环鸟苷酸(cyclic guanosine monophosphate,cGMP)/蛋白激酶G(protein kinase G,PKG)途径调控心肌肥厚[23,24]。具有CARD结构域的细胞凋亡抑制因子(apoptosis repressor with CARD domain,ARC)是一种蛋白质,在人类心肌和骨骼肌中高度表达,ARC参与心肌细胞的肥大和凋亡,miRNA-223可以通过抑制ARC的表达诱导心肌肥厚和心力衰竭[25]。动物实验表明,有一种心脏相关环状RNA(heart-related circRNA,HRCR),含有6个miRNA-223结合位点,可在细胞质中与miRNA-223结合起到海绵吸附作用,促进miRNA-223下游靶基因ARC的表达,从而发挥抑制小鼠心肌病理性肥厚和心力衰竭的作用[26,27]。
3.环状RNA与心肌纤维化:
心肌纤维化的病理过程主要为心肌成纤维细胞活性增加,成纤维细胞转化为肌成纤维细胞,导致细胞外基质蛋白(如胶原蛋白Ⅰ、Ⅲ)的大量分泌,造成细胞外基质过度积累。纤维化相关蛋白包括胶原蛋白Ⅰ、胶原蛋白Ⅲ和α-平滑肌肌动蛋白等,研究表明环状RNA_000203可特异性增强Ⅰ型胶原α2链(collagen type Ⅰα 2,Col1α2)、Ⅲ型胶原蛋白α1链(collagen type Ⅲα1,Col3α1)和心肌成纤维细胞中α-平滑肌肌动蛋白的表达,从而促进心肌纤维化。miRNA-26b-5p可与Col1α2和结缔组织生长因子(connective tissue growth factor,CTGF)的3’UTR相互作用,抑制心肌成纤维细胞中Col1α2和CTGF靶基因的表达从而抑制心肌纤维化。而环状RNA_000203中有2个miRNA-26b-5p的结合位点,可对miRNA-26b-5p产生海绵吸附作用,可阻断miRNA-26b-5p与Col1α2和CTG 3’UTR的相互作用,从而消除miRNA-26b-5p的抗心肌纤维化的作用[28]。Zhou和Yu[29]发现在血管紧张素Ⅱ处理过的糖尿病小鼠的心肌和心肌成纤维细胞中,环状RNA_010567的表达明显上调,采用生物信息学分析预测并通过荧光素酶报告基因测定验证了其具有miRNA-141海绵吸附作用,可间接调节转化生长因子β1(transforming growth factor-β1,TGF-β1)的表达。体外实验表明,沉默环状RNA_010567可使miRNA-141表达上调,从而下调TGF-β1表达,并抑制心肌成纤维细胞中纤维化相关蛋白的合成,证实环状RNA_010567/miRNA-141/TGF-β1轴在心肌纤维化中起到重要的调节作用。
环状RNA类血管动蛋白1(angiomotin-like 1 gene,Amotl1)是来自11号染色体的最大外显子——外显子3,与细胞增殖密切相关,可促进成纤维细胞的增殖与迁移,可通过调节内皮细胞迁移和毛细血管形成在心血管疾病中发挥要作用。有研究报道环状RNA_Amotl1可通过调节信号转导和转录激活子3(signal transducer and activator of transcription 3,Stat3)的水平加速伤口愈合[30]。心肌纤维化可导致心脏重构,引起多种心脏疾病,这些研究对了解心肌纤维化的发生机制具有重要意义。
4.环状RNA与房颤:
房颤是一种常见的心律失常,目前治疗方法主要包括药物和导管消融,了解其发病的分子机制非常重要[31]。Hu等[32]发现房颤患者51种环状RNA表达上调,57种环状RNA表达下调。该研究通过生物信息学分析发现环状RNA-miRNA调控网络可能是影响房颤发生发展的重要通路。Hu等[33]同样发现房颤患者环状RNA表达差异,其中chr9:15474007-15490122、chr16:75445723-75448593、人类环状RNA_0007256、chr12:56563313-56563992和人类环状RNA_0003533可能通过炎症反应影响房颤的发生。提示环状RNA与房颤的发生有一定关系,但具体机制仍需进一步深入研究。
三、环状RNA与血管的疾病
1.环状RNA与动脉粥样硬化:
INK4环状反义非编码RNA(circular antisense non-coding RNA in the INK4 locus,circANRIL)来源于染色体9p21基因位点,在人类血管组织、平滑肌细胞和巨噬细胞/单核细胞中表达。circANRIL可与核仁蛋白(pescadillo homologue 1,PES1)中富含C末端赖氨酸的结构域结合,阻止前体核糖体RNA的结合和核酸外切酶介导的核糖体RNA成熟,从而影响核糖体生成,导致p53活化,从而增加细胞凋亡、抑制细胞增殖,发挥抗动脉粥样硬化作用[34]。脂蛋白受体6基因是一种在血管中高表达并与血管疾病有关的基因,脂蛋白受体6的可变剪接可形成环状RNA_低密度脂蛋白受体相关蛋白6(low-density lipoprotein receptor-related protein 6,Lrp6),环状RNA_Lrp6在人和小鼠间具有物种保守性,拥有多个miRNA-145的结合位点,具有miRNA-145的海绵吸附作用,通过调节miRNA-145的靶基因整合素β8、肌成束蛋白、Krüppel样因子4、YES原癌基因1、赖氨酰氧化酶的表达,影响miRNA-145介导的血管平滑肌细胞的迁移、增殖和分化,从而影响血管疾病的发生、发展[35]。亦有细胞实验发现环状RNA_WD重复域77(WD repeat domain 77,WDR77)可通过miRNA-124的海绵吸附作用调节成纤维细胞生长因子2的表达,促进人类血管平滑肌细胞的增殖和迁移[36]。此外,体外实验还证明环状RNA(环状RNA_0003575)可抑制氧化型低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)诱导的人类血管内皮细胞增殖和血管生成[37]。干预环状RNA的表达有望成为动脉粥样硬化治疗的潜在靶点。
环状RNA_284在人血管平滑肌细胞和颈动脉斑块中都有所表达,Bazan等[38]分别检测了颈动脉内膜切除术后24例无症状和17例急性缺血性脑血管事件患者的miRNA-221、222、145以及环状RNA_284的血清水平,发现后者血清中miRNA-221表达下降,环状RNA_284与miRNA-221的比值升高,提示环状RNA_284/miRNA-221与动脉粥样斑块及卒中的发生有一定关系。Zhang等[39]采用高脂饮食诱导了兔动脉粥样硬化模型,采用RNA测序(RNA-seq)检测了环状RNA、miRNA与mRNA,发现7个环状RNA(环状RNA_18038、18298、15993、17934、17879、18036和14389)与动脉粥样硬化有关。Li等[40]建立了大鼠颈总动脉损伤模型,通过测序发现环状RNA在颈动脉内膜损伤组与正常血管组间表达有差异,38种环状RNA在增生的血管内膜中表达上调,35种下调,血管内膜损伤相关环状RNA可能通过影响多个靶基因的表达,调控血管细胞的分化、增殖和迁移。
动脉粥样硬化可导致缺血性疾病的发生,与心绞痛、缺血性卒中等心脑血管疾病密切相关,对动脉粥样硬化相关环状RNA的进一步研究有利于从基因转录调控水平了解动脉粥样硬化的发病机制,为动脉粥样硬化的防治拓展思路。
2.环状RNA与肺动脉高压:
肺动脉高压是指海平面平静状态下右心导管测量的平均肺动脉压≥25 mmHg(1 mmHg=0.133 kPa),是一种以肺血管阻力增加为特征的罕见但严重的疾病,随着病情的发展,右心室负荷增加最终可导致右心衰竭[41]。Miao等[42]通过采集5例慢性血栓性肺疾病患者的外周血,检测环状RNA水平,结果发现这些患者中122种环状RNA表达上调,229种表达下调,研究还发现人类环状RNA_0002062和环状RNA_0022342与慢性血栓栓塞性肺动脉高压的发展相关。Wang等[43]通过缺氧诱导小鼠肺动脉高压模型,并检测了其肺组织环状RNA的表达情况,发现23种环状RNA表达上调,41种表达下调,进一步采用生物信息学与基因组分析等发现小鼠环状RNA_004592和018351在缺氧诱导肺动脉高压的发生中发挥了重要作用。目前环状RNA与肺动脉高压的分子机制研究主要采用信息学分析,具体分子机制通路尚有待进一步深入研究。
3.环状RNA与腹主动脉瘤:
腹主动脉扩张至原直径1.5倍以上称作腹主动脉瘤,可以没有症状,一旦动脉瘤破裂,病死率可达90%,腹主动脉直径>5.5 cm时需行外科手术治疗[44]。Wang等[45]通过注射3,4-苯并芘和血管紧张素Ⅱ建立小鼠腹主动脉瘤疾病模型,分离主动脉后检测环状RNA的表达,发现271种环状RNA表达上调,142种表达下调,进一步通过实时荧光定量PCR验证了上述结果,其中环状RNA_009839、009537、004742、014193、002856表达上调,环状RNA_002813、013683、018331、001265表达下调,通过生物信息学等方法进一步研究发现这些环状RNA主要与miRNA相互作用调控其靶基因表达,介导腹主动脉瘤形成。此外,有学者通过分析28例男性与7例女性主动脉瘤患者主动脉组织中环状RNA的表达,发现与正常人比较其表达有差异,其中人类环状RNA_00595的表达明显上调,进一步研究发现其主要通过与miRNA-19a相互作用影响人血管平滑肌细胞凋亡,从而影响主动脉瘤的形成[46]。腹主动脉瘤形成的基因调控网络包括细胞凋亡途径、白细胞介素-17信号通路和血管内皮生长因子信号通路等,环状RNA可能通过参与上述途径调控腹主动脉瘤的形成,具体机制尚有待进一步深入研究。
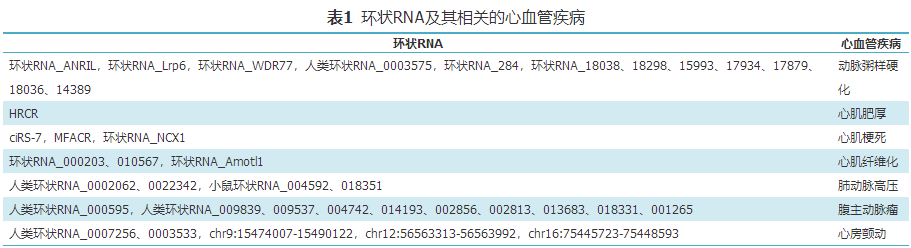
综上所述,环状RNA与多种心血管疾病的发生密切相关(表1)。研究方法主要是首先采用RNA芯片筛查与疾病相关的环状RNA,然后通过实时荧光定量PCR验证上述结果,并挑选表达有差异的环状RNA进一步探索其作用机制。多数研究采取了生物信息学方法预测环状RNA与miRNA的相互作用,并通过体外细胞实验验证其因果关系。这些研究初步探索了环状RNA与心肌损伤、心肌肥厚、心肌纤维化、肺动脉高压、房颤等的关系,揭示了环状RNA在心血管疾病中扮演着重要角色,使我们对心血管疾病的发生与发展有了更多了解。
总之,心血管疾病是21世纪威胁人类健康的重大疾病,是多种危险因素综合作用的结果,不仅与遗传、环境密切相关,还与生活习惯有很大关系。环状RNA与心血管疾病关系的研究为我们了解心血管疾病提供了一个新的视角,为药物的研发和基因靶向治疗拓展了思路。但是对环状RNA在特定心血管疾病中的具体调控机制仍有待阐明,了解心血管疾病相关环状RNA在细胞中的具体位置、运输机制、与蛋白质及miRNA等其他分子相互作用的具体信号通路等非常重要,但目前仍缺乏相关的系统性的研究。环状RNA与miRNA或蛋白质相互作用,可调节多个靶基因的表达,可能涉及疾病发生的多条信号通路,目前相关研究仍处于初级阶段,要将其转化为特定心血管疾病的诊治靶点,仍任重道远。基于环状RNA的保守性及细胞、组织的特异性,将其作为临床上疾病诊断的生物标志物指日可待。




原文在哪看