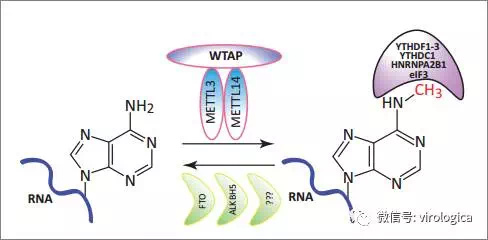
RNA甲基化修饰约占所有RNA修饰的60%以上,而N6-甲基腺嘌呤(m6A)在甲基化修饰中更为普遍。m6A甲基化修饰同时受到甲基转移酶(METTL3,METTL14,WTAP等),去甲基化酶(FTO,ALKBH5等)以及一些m6A修饰结合蛋白-读码器(YTHDF1/2/3, ELAVL1等)的共同调控。
目前已知,m6A修饰广泛存在于原核生物和真核生物中,在基因表达,RNA剪切、mRNA翻译等方面均发挥重要的调控作用。2017年1月份至今,国内外学者接连在Nature、Cell Reports、Cell Research、Cancer Cell等杂志发表了m6A甲基化修饰的新的重要功能,发现m6A与癌症发生和转移、胚胎发育、脂类代谢、环状RNA翻译、DNA损伤修复等均有紧密联系。接下来,我们将重点总结m6A甲基化修饰领域内这些新的研究成果。
一、m6A甲基化修饰与癌症密切相关
1. Cell Reports| m6A调控胶质母细胞瘤干细胞的自我更新和肿瘤分化
2017年3月14日,Cell Reports杂志发表了来自芝加哥大学何川教授和美国希望城贝克曼研究所Yanhong Shi团队有关m6A甲基化修饰调控胶质母细胞瘤干细胞分化的研究成果。文章题目为“m6A RNA Methylation Regulates the Self-Renewal and Tumorigenesis of Glioblastoma Stem Cells”。
m6A甲基化修饰在胚胎发育、细胞凋亡、病毒感染等方面具有重要的作用,然而,m6A与肿瘤发生有何联系还不清楚。胶质母细胞瘤干细胞(glioblastoma stem cell,GSC)是恶性肿瘤内极少量存在的种子细胞,是临床上肿瘤耐药和患者高死亡率的关键因素。本研究发现,m6A参与GSC的自我更新和分化的调控。在细胞内敲低甲基转移酶METTL3和METTL14蛋白的表达,可以诱导 GSCs内原癌基因ADAM19、EPHA3和KLF4 mRNA的表达,促进GSCs的生长、自我更新和分化。相反,过表达METTL3蛋白或者敲低去甲基化酶FTO则抑制GSC的生长和分化以及肿瘤的生长,延长GSC移植小鼠的寿命。
图2 m6A甲基化修饰调控GSC自我更新和分化
该研究首次揭示了m6A与GSC分化的关系,为GSC的治疗提供了重要理论依据。
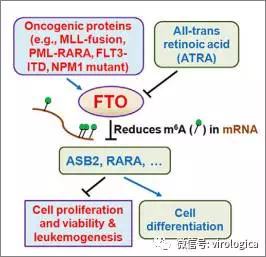
2.Cancer Cell | FTO在急性髓细胞白血病中扮演原癌基因的角色
来自芝加哥大学的何川教授和陈建军(音译)教授合作阐明了去甲基化酶FTO在急性髓细胞白血病(acute myeloid leukemia,AML))发生发展过程中的作用。在AML病人体内,FTO表达水平升高,可以降低抑癌基因ASB2和RARA基因mRNA m6A甲基化修饰水平,调控ASB2和RARA的表达,促进白血病原癌基因介导的白血病细胞转化,FTO还可以抑制全反式维A酸(all-trans-retinoic acid ,ATRA)介导的细胞分化作用。
本研究阐明了m6A甲基化修饰及相关蛋白(FTO)在癌症细胞中的作用,为急性髓性白血病的预防和治疗提供了新的思路。
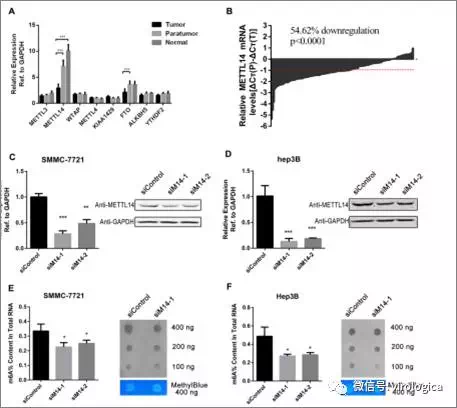
3. HEPATOLOGY | METTL14抑制肝细胞癌的转移
上海第二军医大学Shuhan Sun研究团队则揭示了METTL14在抑制肝细胞癌转移方面的重要作用。在肝癌细胞内,m6A甲基化修饰水平显著降低。下调METT14的表达,可以促进肿瘤的发生以及肝细胞癌的转移。进一步的研究发现,METTL14可以与DGCR8蛋白相互作用,以m6A依赖的方式正调控初始microRNA 126的表达,而后者可以负调控METTL4的表达,促进肿瘤的发生和转移。
该研究揭示了METTL4在肝细胞癌发生过程中的重要作用,为m6A甲基化修饰与肿瘤的关系提供了新的证据。
二、Nature | m6A甲基化修饰在早期胚胎发育中具有重要作用
在哺乳动物早期胚胎的发育过程中,母体-合子过渡(maternal-to-zygotic transition,MZT)是一个非常严密有序的过程,胚胎自身的基因组被激活,而母源的mRNA被清除。然而,对母源mRNA如何进行清除的机制研究较少。来自芝加哥大学的何川教授团队研究发现,约三分之一的斑马鱼母源mRNA可以发生m6A甲基化修饰。YTHDF2可以识别修饰后的mRNA,并介导m6A依赖的RNA降解过程。移除斑马鱼胚胎内的Ythdf2会延缓母源mRNA的降解,抑制合子基因组的激活,使斑马鱼胚胎发育受限。
该研究首次揭示了YTHDF2介导的m6A依赖的mRNA降解在斑马鱼胚胎母体-合子过渡过程中的重要功能,表明mRNA的m6A甲基化修饰在转录组转换和胚胎发育中具有重要作用。
三、Nature| m6A甲基化修饰参与调节紫外线引起的DNA损伤反应
2017年1月,来自波士顿儿童医院Yang Shi和芝加哥大学何川教授团队联合发表了m6A甲基化修饰参与DNA损伤反应的研究成果。原文题目为:“RNA m6A methylation regulates the ultraviolet induced DNA damage response”。
研究发现,在紫外线所致的DNA损伤反应过程中,m6A甲基化修饰的RNA迅速在DNA损伤位点聚集,促进损伤的修复,该过程由甲基转移酶METTL3和去甲基化酶FTO共同调控。当METTL3的催化活性被抑制后,细胞的修复进程将变得迟缓,环丁烷嘧啶加合物聚集,细胞对紫外线的照射更加敏感。进一步的研究发现, 过表达DNA聚合酶κ(Pol κ)可以抑制METTL3减少所致的环丁烷嘧啶二聚体的聚集。
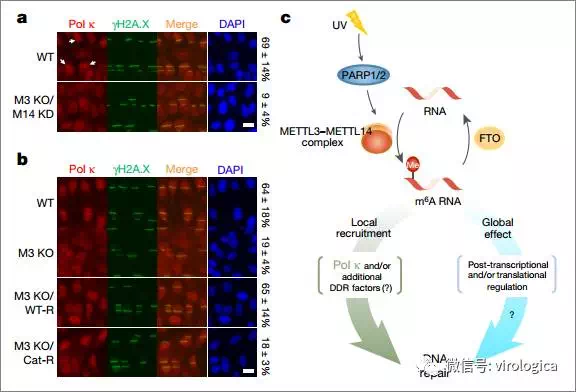
图6 m6A甲基化修饰招募Pol κ参与调节紫外线引起的DNA损伤反应
本研究揭示了m6A甲基化修饰在紫外线所致DNA损伤反应中的新的功能,METTL3催化的含有m6A修饰的RNA可以招募Pol κ到DNA损伤位点,调控修复,利用细胞的存活。
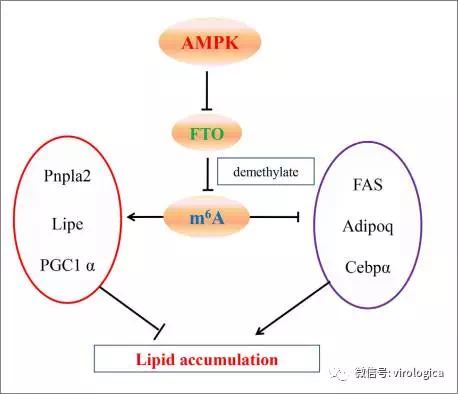
四、Sci Rep | m6A调节骨骼肌细胞中脂类代谢
AMP激活的蛋白激酶(AMPK)是骨骼肌内脂肪代谢的关键调节因子,来自浙江大学的Yizhen Wang团队研究发现m6A甲基化修饰也参与了脂类代谢的调节。研究表明,抑制AMPK促进脂质的积累,激活AMPK则减少脂质在骨骼肌内的积累,而在这一过程中,骨骼肌细胞内mNA的m6A甲基化水平也会发生相应的降低和升高。进一步的研究发现,AMPK通过调控FTO的表达,改变骨骼肌细胞内的m6A甲基化水平,进而调节脂质代谢。
图7 m6A甲基化修饰参与脂质代谢的调控
该研究揭示了m6A甲基化修饰与脂质代谢的相互联系,阐明了去甲基化酶FTO介导的m6A去甲基化作用在脂质代谢过程中的重要作用,为脂质代谢障碍的防治提供了新的理论依据。
五、m6A修饰调节一些特殊RNA的表达和翻译
1. Cell Res|m6A甲基化修饰调控环状RNA(circRNAs)的翻译
环状RNA(circRNAs)广泛存在于真核生物细胞中,由前体mRNA(pre-mRNA)通过“back-splicing”的方式产生,目前circRNA的生物学功能研究较少。中国科学院上海生命科学研究院的王泽峰研究员带领的研究团队发现,在circRNA中,存在保守的m6A模体和甲基化修饰位点,调控circRNA的翻译。m6A诱导的circRNA翻译过程需要翻译起始因子eIF4G2和m6A读码器YTHDF3的参与,而且甲基转移酶METTL3/14对circRNA的翻译起促进作用,而FTO则抑制circRNA的翻译。
通过进一步的生物信息学和质谱鉴定技术,发现m6A驱动的cirsRNA翻译广泛存在于细胞内。该研究扩展了对人类转录组编码的认识,指出在外界环境压力下,细胞内m6A甲基化修饰促进circRNA的翻译。
2.JBC | m6A修饰调控mRNA的降解
很多研究都报道了YTHDF2可以介导m6A甲基化修饰的mRNA的降解,然而YTHDF2的调控机制研究的较少。天津南开大学张晓东教授团队发现,在肝癌细胞中,microRNA-145与YTHDF2的水平呈负相关。过表达microRNA-145后,YTHDF2的表达水平降低,m6A甲基化修饰水平升高;相反,抑制microRNA-145的表达后,YTHDF2的表达水平显著升高,而细胞内mRNA的m6A修饰水平明显降低。进一步的研究表明,microRNA-145通过作用于YTHDF2 mRNA的3’末端非编码区(3’ UTR)发挥负调控作用。
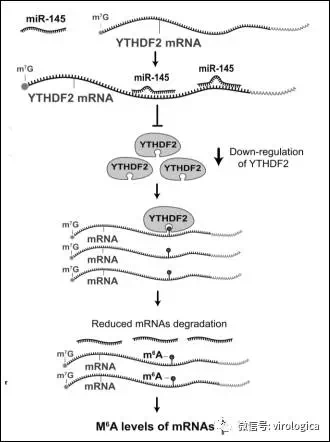
图9 microRNA-145负调控YTHDF2介导的m6A修饰的mRNA的降解
来源:中国病毒学(本文由中科院武汉病毒研究所徐焕洲博士供稿)






来第一个抢占沙发评论吧!