作者:天昊生物
环状RNA (circRNA)是一类具有封闭环状结构,并且不易降解的RNA分子。虽然第一个circRNA早在40多年前就被发现的,但是人们对它的大规模研究却是近十几年的事情。

今年7月刚刚在Wiley Interdiscip Rev RNA上发表的综述性文章“A 360o view of circular RNAs: From biogenesis to functions”,就详细总结了环状RNA的生物发生和功能等研究进展况。
前言
由于大多数真核基因是以分段的方式排列的,新生转录本通常需要被剪接,去掉非编码内含子后,使得外显子彼此结合。人们早已认识到,基因表达中的这一步骤受到高度调控,利用这种机制可以从特定基因中产生多种mRNAs,每个成熟的亚型可以具有独特的功能、定位模式或调节作用。在人类基因组中,95 %以上的基因是具有可变剪接的,它们通常由顺式调节元件和反式作用因子共同调控。这其中,除了产生各种线性mRNA之外,许多真核基因也产生出具有末端共价连接的环状RNA。
通过名为反向剪接(backsplices)的剪接机制,mRNA前体被剪切后,其剪切供体会连接到上游剪切受体上,例如图1中外显子2的末端连接到外显子2的起始段,便会形成circRNA。尽管第一个circRNA早在40多年前就被鉴定出来,但这些转录本在细胞中基本上被认为是非常罕见的,所以长期被人们忽略。近期研究表明,多数circRNA较难产生,并且积累水平较低,但有些表达水平比相关的线性mRNA都高10倍,这也暗示一些蛋白质编码基因的主要功能可能是产生circRNA,而不是线性mRNAs或蛋白质。
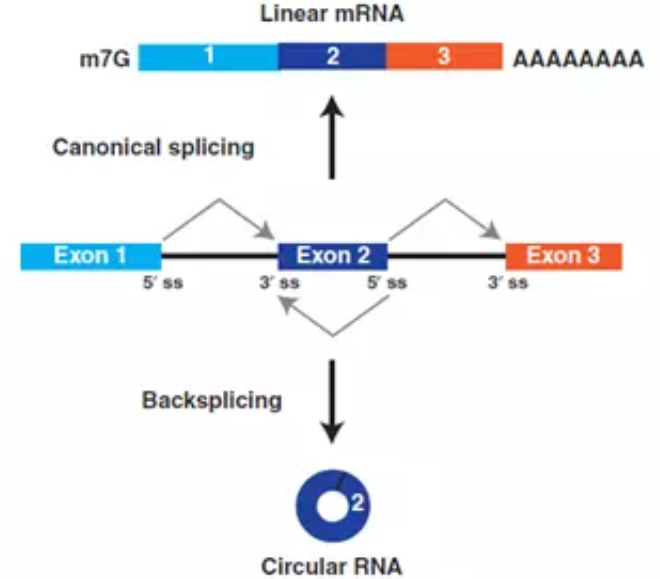
图1、mRNA前体可以通过选择性剪接产生线性mRNA或者circRNA。如果mRNA前体剪接位点(ss)以线性顺序连接,则产生成熟的线性mRNA,成功的被加帽和多聚腺苷酸化。或者,mRNA前体通过“backsplices”的剪接机制,使得5’ ss与其上游3’ ss剪接受体结合,从而产生末端由3’-5’磷酸二酯键共价连接的circRNA
本文重点回顾了过去几年来在揭示细胞中存在的circRNA多样性方面取得的巨大研究进展,并讨论这些转录本是如何生成、调控和发挥功能的。
对circRNA的早期认识
circRNA最早是在1976年人们研究类病毒(viroids)如何作为植物病原体发挥作用时被发现的。以前已知类病毒与病毒相似之处在于它们具有传染性和致病性,但尚不清楚类病毒是如何起作用的,因为它们看起来是相当小的RNA (<400 nt),并且没有蛋白质外壳的保护。通过对纯化的类病毒RNA分子研究,Sänger等人证明类病毒RNA无法对其3’端和5’端进行标记,也无法被蛇毒磷酸二酯酶降解。电子显微镜结果显示类病毒RNA结构上呈现一种单链环的形状。随后Gross等人1978年发表在Nature上的文章,对类病毒进行了测序并证明它们确实是真正的circRNA。之后在circRNA领域虽然取得了一些成果,但直到20世纪90年代人们才成功鉴定出高等真核生物中表达的第一个内源性circRNA。Nigro等人通过对一个肿瘤抑制基因-结直肠癌缺失基因(DCC)几个异常剪接转录本的分析,发现在一些转录本中,外显子3似乎位于外显子2的上游,这些被打乱的转录本似乎没有被聚腺苷酸化,但为正常剪接DCC转录本表达量的约1/1000。随后对人ETS-1也有类似的研究,发现了高度稳定的circRNA(半衰期>48 h)。
之后研究也证明circRNA可以是某些蛋白质编码基因的主要输出形式,并且对小鼠Sry基因的研究提出了关于如何选择特定外显子进行环状化的第一个机制见解,即在Sry外显子旁的内含子中存在约50kb的近乎完全互补的序列,可以形成circRNA,暗示这些侧翼序列可能能够彼此碱基配对,从而将剪接供体定位在靠近其上游剪接受体的位置,并有利于反向剪接。与该模型一致,利用质粒实验也显示细胞中Sry外显子的环化确实需要存在两个反向重复。在使用核提取物检测体外反向剪接时,同样显示内含子反向重复促进了circRNA的产生,特别是当外显子尺寸增加时。这些体外实验进一步有力地表明,circRNA是由剪接体产生的,但反向剪接可能比典型剪接反应效率低100倍以上。在随后的几年中,又发现了一些内源性circRNA,并发现外显子跳跃和反向剪接有时紧密相连。直到后来高通量RNA-seq方法的兴起,circRNA的广泛而重要的作用才被揭示出来。
高通量测序技术引发circRNA研究的兴起
大约从10年前开始,许多研究者开始使用RNA-seq来表征“完整”转录组,来鉴定各种先前未标记的剪接变体和非编码RNA。然而,这些初步分析遗漏了circRNA。这在很大程度上是由于两个原因导致:一是在文库制备方案中广泛使用了poly(A)富集步骤,从而丢失了circRNA和缺乏poly(A)尾巴的其他转录本信息;二是使用了要求RNA-seq读数以线性方式与基因组对齐的计算算法,从而导致以反向剪接方式连接的所有reads被丢弃。直到Salzman等人在2012年利用RNA-seq试图识别由染色体重排引起的癌症特异转录本时,才意外的发现了成千上万在细胞中表达的circRNA。在这项研究中,他们从白血病细胞中鉴定出数百个外显子顺序混乱的转录本,但令人惊讶的是,这些转录本绝大多数也在正常细胞中观察到。这表明这些异常的RNA不是由于基因组DNA的结构重排,而是由于在所有细胞中活跃的剪接过程造成的。它们同样缺少poly(A),并且对消化几乎所有线性RNAs的RNase R具有抗性。
随后的RNA-seq研究证实了这些初步观察,并鉴定了数以千计的circRNA,这些circRNA是从包括后生动物、植物、真菌和原生动物在内的各种真核生物的蛋白质编码基因中产生的。这些假定的circRNA中的许多已经被收录到几个在线数据库中,包括circBase、CIRCpedia和CircInteractome。一般来说,在给定的细胞类型中,可以从超过10%的表达基因中检测到circRNA,并且circRNA的水平与其相应的mRNA之间通常没有明确的相关性。大多数circRNA是组织特异性的,表达水平较低,但也有一些在多个物种中表达较高,并且有数百个基因以比标准线性mRNA更高的水平表达。这在神经系统尤其如此。例如,在果蝇中,90%以上注释的circRNA可以在头部检测到,而这些转录本的一半在任何其他组织中都没有检测到。由于circRNA在神经发生过程中经常上调,并可在突触中富集,因此有人认为它们可能对神经元功能有反应和/或调节作用。
circRNA的高通量鉴定
用去核糖体RNAs (rRNAs)和使用随机引物的RNA-seq,已成为目前鉴定circRNA的主流方法。此外,在许多方案中,会进一步采用核酸外切酶如RNase R或poly(A)富集步骤来去掉线性mRNAs。另外,目前也已出现了包含有反向剪接探针的芯片。在计算方面,已经开发了多条可以从RNA-seq数据集中识别circRNA的管线,包括find_circ、CIRI、KNIFE、NCLScan、Segemehl、DCC、UROBORUS和PTESFinder等。尽管所有这些算法都支持circRNA的识别,但是它们预测的circRNA集合确实也存在显著差异的情况。有研究曾将相同的RNA-seq数据集被独立地输入到五个算法中时,许多(~40%)假定的circRNA仅由单个算法预测出。预测的circRNA总数从1532个到4067个不等,所有五种算法仅鉴定出854个共有circRNA。因此,各种算法在灵敏度和精度上存在较明显差异,目前该领域缺乏从RNA-seq数据集识别circRNA的金标准方法。因此,本文建议使用多个独立的管线来鉴定circRNA候选物,并随后使用独立的方法对候选物进行验证,包括包含有反向剪接点的RT-PCR和Northern blotting。随着RNA-seq分析算法的进一步改进,计算消除噪音和仅识别真正的circRNA也会变得更加容易。
内含子重复之间的碱基配对有利于circRNA的产生
所有内部外显子(不包括基因的第一个和最后一个外显子)在其3’端和5’端都有剪接信号,理论上都可以被环化。然而,在细胞中只观察到一小部分的反向剪接事件发生,部分原因是这些反应经常以极低的效率发生。当真的发生反向剪接时,它可以产生包含单个外显子的圆形RNA,该外显子通常比平均表达的外显子长,或者包含多个外显子的circRNA。最常见的circRNA有2-3个外显子,内部内含子被去除。因为环状外显子旁的内含子通常比平均值长。2013年的一篇研究发现,在人类circRNA周围寻找到丰富的内含子重复基序,通常观察到成对的Alu重复元件( ~ 300-nt长)。这种排列类似于小鼠Sry circRNA旁侧序列中的互补内含子重复序列,暗示了内含子重复可能是反向剪接的共同驱动因素。事实上,在人类、小鼠、猪、秀丽隐杆线虫和果蝇中,许多高表达的circRNA两侧都常有互补的重复序列,并且可以通过简单地在侧翼内含子中搜索互补序列来准确预测许多circRNA。除了Alu重复元件(灵长类特有的)之外,各种互补序列可以侧翼于circRNA,包括非重复序列。因此,目前认为大多数反向剪接事件不需要特定的序列基序(在剪接位点之外),而是通过侧翼内含子元件之间的碱基配对相互作用来促进。
通过使用表达质粒或通过使用CRISPR-Cas9从内源基因座中去除内含子重复,人们已经证明了内含子重复之间的碱基配对确实可以促进circRNA的生物发生。但由于基因组重复在物种之间存在显著差异,因此不同的真核生物可以表达不同的circRNA。即使蛋白质编码外显子在进化上是保守的,基因的最终输出和功能可能在生物体之间也会有所不同。
在一些基因座中,短内含子重复(~30-nt,包括简单重复)之间的碱基配对能够促进circRNA的产生。尽管如此,内含子重复的存在并不总是足以引发反向剪接,因此,circRNA可以以组织特异性的方式表达。这是由于剪接、热力学、RNA结合蛋白调节共同转录的特性,以及大多数内含子含有竞争碱基配对的多个重复元件决定的。根据重复元件之间的碱基配对方式,可以产生非常不同的剪接异构体(图2)。当碱基配对发生在不同的内含子上时,会诱导反向剪接,产生由插入的外显子组成的circRNA。相反,当碱基配对在单个内含子内局部发生时,发生标准剪接以产生线性mRNA。重复元件的数量、它们之间的距离以及它们的互补程度都影响序列碱基配对,从而影响剪接结果。这种竞争还允许单个蛋白质编码基因产生多个不同的circRNA,这一过程称为可变环化
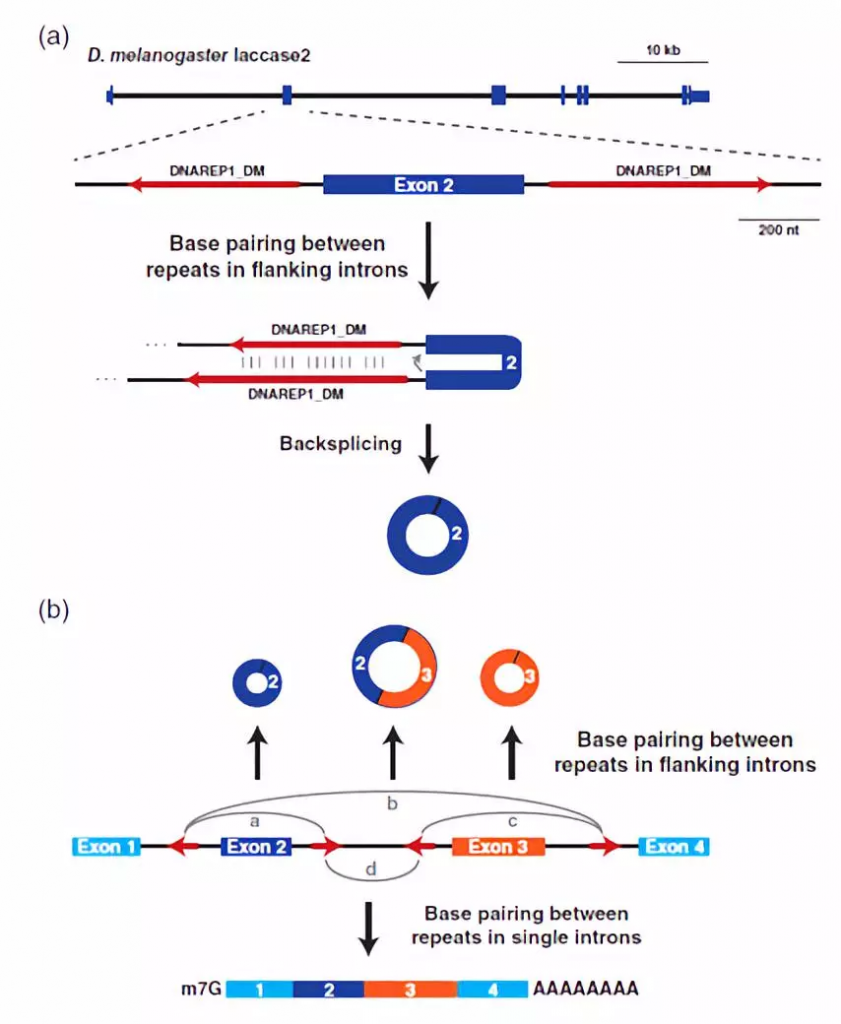
图2、内含子重复序列之间的碱基配对有助于反向剪接事件发生。
(a) 黑腹果蝇laccase2基因的外显子/内含子结构,突出显示可产生490-nt circRNA的外显子2。一对DNAREP1_DM转座子(红色箭头)插入侧翼外显子2。这些内含子序列之间的碱基配对,有利于反向剪接发生。
(b) 当mRNA前体中存在多个内含子重复元件(红色箭头)时,根据彼此的重复碱基对(用灰色弧线表示),可以产生不同的成熟RNA。a-c为不同内含子中重复序列之间的碱基配对导致反向剪接并产生包含单个外显子(a和c)或多个外显子(b)的circRNA。d相反,当在单个内含子碱基对中彼此重复时,产生线性mRNA
外显子跳跃常常与circRNA的生成有关
最近的全转录组分析表明,一些circRNA的生物发生可以与外显子跳跃(或称外显子跳读)事件偶联,进而允许从单个mRNA前体产生线性mRNA和circRNA (图3)。在某些情况下,外显子跳跃的mRNA变体以非常低的水平表达,并且仅可通过RT-PCR检测,而不是通过RNA-seq检测。Barrett等人在2015年对mrps16基因的研究中完美地展示了外显子跳跃和circRNA产生之间的强耦合现象。将mrps16基因的外显子1与外显子3剪接导入含有外显子2的内含子套索中,随后会再次剪接以将外显子2的起点和终点连接在一起。由此,这一重新发生的事件产生了成熟的circRNA,潜在的细节虽然尚未完全知晓,但将外显子跳跃与circRNA产生耦合的实验,提供了在没有内含子重复的情况下产生circRNA的另一种发生机制。
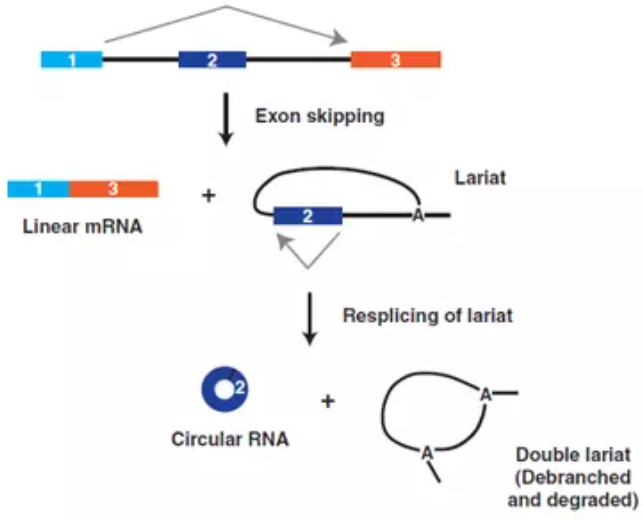
图3、外显子跳跃可直接与circRNA产生偶联。在mrps16基因上,外显子跳跃导致成熟的线性mRNA以及含有外显子2的内含子套索的产生。这种套索被重新拼接以产生成熟的circRNA
通过RNA结合蛋白调控circRNA水平
除了顺式作用的内含子重复和外显子跳跃事件之外,RNA结合蛋白也是circRNA的关键调节子,它们允许这些转录本以组织特异性模式表达或者随着细胞改变而被诱导/抑制。例如,内含子重复本身可以直接与反式作用因子结合,包括NF90/NF110或者结合双链RNA的RNA解旋酶DHX9。DHX9结合可抑制反向剪接反应,可能是通过直接解链双链内含子区,或通过募集ADAR (作用于RNA的腺苷脱氨酶)酶将腺苷转化为肌苷。由于DHX9在分化过程中上调,有人提出,这些DHX9驱动的机制可使细胞主动抑制多种circRNA的产生。另一方面,选择性剪接因子QKI促进了人类上皮-间充质转化(EMT)过程中数百个circRNA的产生。这似乎是因为QKI与侧翼内含子结合并形成二聚体,从而使插入的剪接位点非常接近(类似于反向重复如何促进反向剪接)。果蝇(Mbl)蛋白同样可以结合自身mRNA前体中的内含子元件,以促进circRNA的产生,从而自动调节宿主基因表达,并确保Mbl蛋白水平保持在一个严格的范围内。
circRNA的生成可以可以进一步被FUS以及由多个hnRNP和SR蛋白质调控。如上所述,果蝇laccase2 circRNA的产生通过内含子重复元件之间的碱基配对来促进,但其表达也受到多个hnRNPs和SR蛋白的抑制。有趣的是,这些剪接因子的同时缺失导致laccase2 circRNA水平的增加,这表明每个因子在影响剪接决定方面起着非冗余作用。因此,circRNA以组合方式受到控制,内含子重复通常提供了发生反向剪接的机会,以及各种微效的调控。考虑到每个外显子或内含子都有自己独特的一组蛋白结合位点,人们可以很容易地想象这种编码如何被用来产生各种不同的circRNA表达模式。
当剪接机制受限时基因输出方式转向circRNA
尽管突变剪接位点可以导致circRNA无法生成,在果蝇上的研究发现,当细胞中的核心剪接体或转录终止因子不足时,circRNA可以成为首选的基因输出形式。核心剪接体成分的缺失导致接合的线性mRNA表达降低。与此形成鲜明对比的是,我们发现,当细胞中功能截然不同的因子从剪接体中耗尽时,许多单外显子环状RNA,包括laccase2 circRNA的表达增加。
在剪接体组装的早期过程,特别是在外显子初始鉴定的机制中,较好的诠释了经典剪接和反向剪接之间敏感性的差异(图4)。在外显子定义期间( Berget,1995 ),U1和U2 snRNPs结合在每个外显子的相对端,并由蛋白质-蛋白质相互作用来加以稳定,该作用网络包括附加因子,例如SR蛋白质。然后,这些外显子相互作用必须转化为交叉内含子相互作用(将剪接位点与独立内含子配对),以产生经典剪接的线性mRNA。然而,为了产生circRNA,这些初始外显子复合物可能不会被破坏,而是可以直接转化为有催化能力的反向剪接复合物。当核心剪接体从细胞中耗尽时,交叉外显子相互作用不容易被交叉内含子相互作用取代,从而使单个外显子circRNA成为首选的剪接结果。目前还不清楚反向剪接是否使用与标准剪接反应完全相同的核心剪接体成分,但这项工作为思考如何获得circRNA水平的整体变化(至少是由单个外显子产生的变化)提供了参考。如果一个组织具有有限数量的剪接体成分,预计将产生更高水平的circRNA,特别是高度转录的基因。因此,确定这一模型在产生最高数量circRNA的神经元或衰老组织中是否成立将是非常有意义。
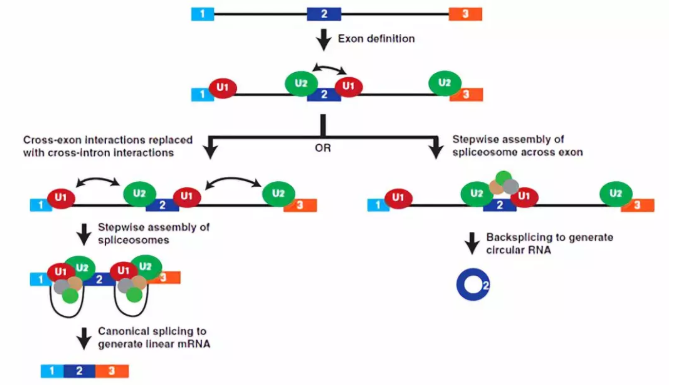
图4、剪接体组件决定标准拼接或反向剪接发生模型。在具有长内含子的mRNAs前体中,剪接体组件首先在每个外显子上组装。U1 snRNP (红色)和U2 snRNP (绿色)分别识别5’端和3’端的剪接位点,另外一些因子,如SR蛋白,用于稳定外显子复合体。这些跨外显子的相互作用必须被跨内含子的相互作用取代,以便产生成熟的线性mRNA (左)。然而,当剪接体的活性受到限制时(例如由于核心剪接体组件的耗尽),跨外显子的相互作用可能不容易被破坏,而完全剪接体聚集在外显子上,导致反向剪接的产生(右)
circRNA可以调控microRNA的活性和水平
一旦circRNA生成后便可以自然抵抗外切核酸酶降解,并作为稳定转录本积累(例如,统计了60个人类circRNA半衰期中位数为约24小时)。那么circRNA的分子功能是什么呢?超过99.9%的已鉴定circRNA,功能仍然未知。在已知功能circRNA中,一些用于调控microRNA。microRNA是一种约21-nt的小RNA,通过与mRNA碱基配对和抑制蛋白质产生和/或引发mRNA降解而在转录后发挥作用(图5a)。通过在circRNA中寻找保守的microRNA靶向位点,例如小鼠Sry circRNA含有16个miR-138结合位点,而CDR1as则含有70多个miR-7进化保守的结合位点。因此,这些circRNA可以用作诱饵或海绵,降低了游离miR-138或miR-7转录本的数量。CDR1as衍生自反义长非编码RNA,CRD1as中存在约70个miR-7结合位点,没有一个与miR-7完全互补,miR-7允许circRNA紧密结合但不被miR-7切割。与这一观点一致,耗尽细胞中的CDR1as将导致miR-7靶mRNAs下调,可能是因为miR-7不再被隔离导致。CDR1as还含有与miR-671几乎完全互补的区域,这使得circRNA能够以依赖于miR-671的方式被Argonaute2 (AGO2 )核内切割。这就产生了一种模型,其中CDR1as有助于储存和/或运输miR-7 (与Argonaute蛋白结合),直到miR-671切割circRNA,释放miR-7,从而可以调节mRNA在特定亚细胞位置的表达(图5a)。
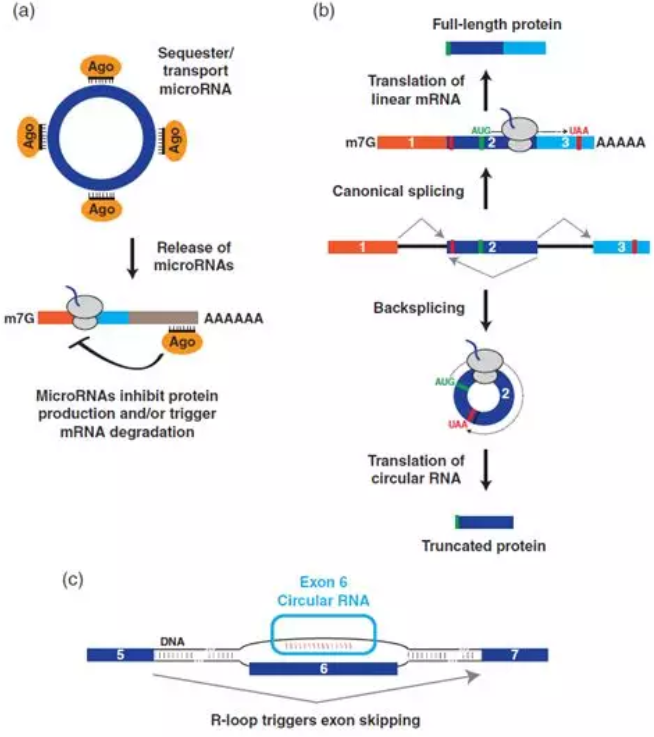
图5、circRNA可以具有多种分子功能。
(a)一些circRNA,包括CDR1as和Sry,能够结合许多拷贝的特定microRNA,响应于特定刺激,circRNA可能释放这些microRNA转录本,然后这些转录本结合到mRNA可以下调它们的表达。
(b)最近研究表明,来自同一基因座的线性mRNAs和circRNA可以被翻译成不同的蛋白质产物。在所示的实施例中,成熟的线性mRNA (顶部)和circRNA (底部)使用相同的AUG起始密码子(绿色),但是circRNA产生截短的蛋白质,该蛋白质终止于反向剪接连接后遇到的终止密码子。
(c)拟南芥SEP3 circRNA的一些拷贝保留在细胞核中,在内源SEP3基因座形成R环( RNA:DNA杂交体),影响宿主基因的可变剪接
在小鼠中,CDR1as circRNA在兴奋性神经元中高度表达,在抑制性神经元、胶质细胞或非神经元组织中表达最少。在除去CDR1as基因区域后,敲除小鼠是存活的、可育的,并且在成人脑解剖结构中没有显示严重异常。但也观察到兴奋性突触传递的缺陷,敲除小鼠表现出感觉运动控制受损,这是一种与神经精神障碍相关的行为表型。这些效应可能是由于CDR1as circRNA的缺失导致。
因此,CDR1as基因座很好地展示了circRNA和microRNA如何具有重要生物学效应的动态相互作用,但对于其他circRNA是否以类似方式发挥作用仍有待进一步研究。这是因为多数带注释的circRNA含有较少的microRNA结合位点。然而,有新的证据表明,包括人类和果蝇中的许多circRNA可能起到海绵吸附特异性microRNA的作用。例如,当人表皮干细胞分化时诱导的circZNF91含有24个miR23b-3p结合位点,这是已知的调节角质细胞分化的microRNA。由于在分化过程中上调的其他circRNA也具有数量显著的microRNA结合位点,有人预测,当细胞改变状态时,一部分circRNA可能会吸附关键的microRNA,因此确定circRNA有助于缓冲调节网络免受干扰将是有趣的研究。
circRNA的翻译
最初的实验表明,由于缺乏5’端帽子结构,真核核糖体不能装载到circRNA上,因此认为无法翻译。但后来证明,内部核糖体进入位点(IRES)的存在使得合成的circRNA能够在体外和细胞中翻译。IRES元件存在于多种病毒中,直接结合翻译起始因子或核糖体本身,从而允许翻译以独立于帽子的方式发生。因为最初的报道没有发现与核糖体共沉淀的circRNA或核糖体图谱库,看来内源性circRNA可能无法募集核糖体。然而,最近有报道指出,内源性circRNA的一个子集实际上可能被翻译。
人circ-ZNF609包含753-nt开放阅读框,与线性mRNA有相同的AUG密码子和终止密码子,该终止密码子在反向剪接连接处遇到三个核苷酸(图5b)。这种circRNA与多聚体和表达质粒共同沉积的一小部分但很重要的部分显示,circ-ZNF609可以被弱翻译(效率比线性mRNA低两个数量级)。有趣的是,circ-ZNF609的敲除导致人和小鼠成肌细胞的增殖缺陷,但来源于circ-ZNF609的蛋白质是否有助于这种表型的产生仍不得而知。
利用质谱技术,鉴定出另外19个人类包含内源性circRNA反向剪接点的的多肽。深度测序数据集也揭示了122个与核糖体相关的果蝇circRNA。对于40%的这些果蝇circRNA,翻译预计使用与宿主线性mRNA相同的起始密码子,并在反向剪接连接点后终止。许多预测的ORFs至少有一个可识别的蛋白质结构域,但必须指出,目前只有一个测序read支持绝大多数这些翻译事件。几乎不可能用核糖体图谱来寻找圆形RNA上的核糖体定相或起始/终止密码子,因此使用mini基因表达质粒、蔗糖梯度离心、突变分析和质谱的组合来进一步验证这些circRNA中的一些确实可以翻译的假设。值得注意的是,该研究表明circRNA翻译可能经常发生在膜相关核糖体上或富含膜(例如突触)的亚细胞结构中。
与预期一致,当插入双顺反子报告子构建体时,circRNA起始密码子上游的区域具有可检测到的IRES活性。对于circZNF609,IRES活性需要剪接,这表明外显子连接复合体的沉积可能会增强一些circRNA的翻译。进一步研究证明,N6-基腺苷( m6A )残基在circRNA中富集 (约13 %的circRNA含有m6A ),这些修饰的核苷酸可以促进翻译。事实上,单个m6A位点可能足以启动合成circRNA的翻译。结合m6A后,YTHDF3 reader蛋白质将翻译起始因子,包括eIF4G2和eIF3A被招募到circRNA上。
由于基于全基因组的研究未能获得circRNA能够翻译的任何证据,这些最近描述的翻译事件中有许多可能代表技术或生物噪声。现在需要进一步的工作来确定有多少circRNA被真正翻译达到显著水平。人们很容易推测,在circRNA的长寿命期间可以产生大量蛋白质,并且这些内源性蛋白质可以充当显性阴性和/或调节与其相关的宿主线性mRNA产生的蛋白质相同的功能。除了自身翻译之外,有越来越多的证据表明,一些circRNA,包括circPABPN1,可以调节它们相关的线性mRNA的翻译。还发现成熟的circRNA与多种其他蛋白质结合,这表明这些转录本可能影响多种其他蛋白质活性或功能。
细胞核内的circRNA调节宿主基因的转录和选择性剪接
大多数表征的circRNA主要位于细胞质中,但现在出现了在细胞核中起作用的circRNA的例子。外显子-内含子circRNA不完全剪接,具有保留的内含子,允许它们与U1 snRNP相互作用并促进宿主基因的转录。在拟南芥中,一个关键的发育调控基因SEPALLATA3 ( SEP3 )的外显子6产生一个circRNA,这些环状转录物中约15%保留在细胞核中(图5c)。值得注意的是,过度表达SEP3 circRNA (但不是外显子6的线性转录本)的植物产生的花比正常植物雄蕊少,花瓣多。这似乎是因为外切表达的circRNA在内源SEP3基因组基因座形成R环(RNA:DNA杂交),这导致跳过外显子6的线性SEP3剪接变体的产量增加(图5c)。由于该SEP3剪接变体的过度表达足以引起与SEP3 circRNA的过度表达相同的同源异型表型,因此该circRNA似乎仅通过调节其宿主基因的可变剪接发挥作用。circRNA究竟是如何做到这一点尚待确定,但有人提出,R环导致SEP3转录暂停,从而可以招募促进外显子跳跃的可变剪接调节因子。值得注意的是,拟南芥中约5%的Rloops对RNase R处理具有抗性,表明其他circRNA也可以结合基因组DNA来调节转录或可变剪接模式。
免疫系统与环状RNA的相互作用
考虑到某些circRNA,包括类病毒和HDV是病原体,人们会期望真核生物免疫系统能够以某种方式感知和消灭这些外来入侵者。事实上,当HeLa细胞被使用自剪接体I内含子体外制备的circRNA转染或剪接连接时,大量众所周知的识别受体,包括RIG-I和MD5,以及其他先天免疫调节子和细胞因子被强烈诱导。因此,细胞能够对外源circRNA产生显著的免疫应答,这种应答实际上比将编码相同序列的线性RNA转染到细胞中时更强。人们对circRNA的感知还不完全清楚,但一些重要的方面已经被揭示出来。首先,RIG-I是免疫应答所必需的,并与外源circRNA共定位。其次,circRNA转录本是自我还是非自我的形成机制被认为是关键决定因素。每当使用自剪接I组内含子制备circRNA时(即使是在来自表达质粒的细胞中制备),观察到强有力的免疫应答。与此形成鲜明对比的是,使用剪接体制备的circRNA总是被认为是自我的(不管成熟circRNA或其侧翼内含子的序列如何)。这大概是因为剪接体在circRNA上沉积了许多RNA结合蛋白,例如外显子连接复合体或核输出机制,这些RNA以某种方式将circRNA标记为自身。以这种方式,细胞能够感应和应答多种外源circRNA,而不管它们的主要序列如何,同时对许多内源circRNA不产生应答。现在还需要进一步的工作来理解RIG-I如何准确识别外来circRNA,以及剪接体反向剪接如何防止自身免疫反应。
除了确保识别外源circRNA之外,多种免疫调节子,包括RIG-I和dsRNA结合蛋白NF90/NF110,似乎也调节内源性环状RNA的表达。在正常生长的细胞中,NF90/NF110与位于许多(~30%)外显子旁的内含子中富含A/U的元件(包括碱基配对的Alu元件)结合,这些外显子产生circRNA并起到促进反向剪接事件的作用。然而,在病毒感染时,NF90/NF110穿梭于细胞质以结合病毒转录本并抑制病毒复制,这导致NF90/NF110结合细胞核中较少的新生mRNA前体,从而导致circRNA的产生减少。有趣的是,NF90/NF110还能够结合细胞质中一些成熟的circRNA,并且实际上比线性RNA对circRNA表现出更高的亲和力。因此,正常生成的circRNA允许在细胞质中建立NF90/NF110的分子库,当需要时,可以释放该分子库,以便能够对病毒感染作出迅速反应。
circRNA在衰老和疾病中的作用
可变剪接模式已经显示随着老化而改变。随着果蝇、秀丽线虫和小鼠衰老,神经系统中circRNA表达有增加的趋势。例如,在2513个检测到的果蝇circRNA中,262个在20日龄头部中与1日龄相比显著上调。值得注意的是,这些表达的增加在很大程度上与宿主基因中线性mRNAs表达的变化无关,并且在衰老小鼠心脏或恒河猴肌肉中没有观察到,这表明circRNA可能在老化的神经系统中首先稳定生成,但目前尚不清楚这种circRNA的积累是保护性的、有害的还是无害的。至少在小鼠身上,从Pwwp2a基因衍生的circRNA似乎有助于防止病理性肥大和心力衰竭。
与正常组织相比,癌细胞z中的circRNA通常下调表达,这可能部分由于细胞分裂稀释造成。与这一观点一致,最近发现,随着细胞分化和增殖停止,circRNA水平经常增加。下调一些circRNA,可以促进细胞生长,过表达则促进增殖。特别值得注意的是,当断点碱基对两侧的内含子序列彼此相邻时,癌症相关染色体易位可导致异常融合circRNA的产生,这些融合circRNA可促进转化、细胞活力和抗性治疗,因此代表了新的治疗靶点。此外,因为一些circRNA存在于外体/胞外囊泡和体液中,circRNA可能代表有希望的癌症生物标志物。将circRNA包装成囊泡可能是从细胞中消除circRNA的一种方式和/或实现细胞间通信的机制。
circRNA研究展望
RNA-seq现已鉴定出数千个circRNA,但仍需记住,绝大多数RNA从未通过正向技术验证或详细研究过。因此,要从这些列表中消除测序假象,区分反向剪接事件事件,以及完全表征circRNA表达模式,还有许多工作要做。然而,越来越多的circRNA现在已经被足够详细地研究,因此我们对它们如何产生、调节和功能有了重要的认识。特别是对生物发生机制的深入了解已经转化为在细胞中表达circRNA的有效方法,并使一些circRNA的功能得以揭示。通过将过表达研究与CRISPR-Cas9产生的circRNA敲除结合起来,未来几年可能会确定更多circRNA的功能。应该可以使用CRISPR-Cas9去除侧翼内含子重复元件,从而剔除感兴趣的circRNA,同时不影响宿主基因的线性RNA产生。
内含子重复对于许多circRNA的生物发生至关重要(图2),但对于基因如何在没有重复的情况下产生circRNA仍不完全了解。例如,在人表皮干细胞分化过程中,大部分circRNA上调或果蝇没有侧翼重复,并且不清楚这些外显子是如何被选择用于反向剪接的。除了外显子跳跃事件(图3),可能还有许多顺式和反式调节机制有待发现,这些机制能够实现特定的circRNA表达模式。此外,还需要进一步研究,以了解反向剪接反应的详细机制,并确定是否涉及所有规范的核心剪接体组件。
一旦产生了circRNA,人们对它们是如何在细胞质中积累,特别是在非分裂细胞中积累的知之甚少。其他种类RNA的特定结构特征被受体蛋白识别,使得这些转录本能够被带到核孔复合体中以输出到细胞质中。circRNA可能存在类似的机制,更好地理解与circRNA相互作用的蛋白质,特别是在它们的生物发生过程中,可能有助于揭示circRNA定位是如何被控制并在发育过程中如何改变的。对于那些与核糖体相关的circRNA (图5b),核糖体在转录物上的组装到底是怎样的,所产生的蛋白质积累到足够高的水平以具有生物学效应?大量未翻译的circRNA可能有助于形成大型RNA-蛋白质复合物,或者以其他方式影响与其亲本基因产生的蛋白质相同的途径。或者,circRNA的产生本身可能是关键的功能事件,因为反向剪接反应可用于降低线性mRNA的表达或终止读通转录事件。
内源性circRNA是如何被识别为自身的,是否有可能在体外产生不引起免疫反应的环状RNA?这一途径可以开辟许多生物技术应用,在这些应用中,用持久的circRNA用于治疗细胞或病人可能是理想的。许多circRNA具有较长的半衰期,但circRNA最终降解的机制仍不清楚。CDR1as circRNA可以被AGO2切割,但这似乎是一个孤立的机制。其他RNA内切核酸酶通常可以通过提供外切核酸酶的接入点来促进circRNA的衰变,并且快速降解的circRNA的鉴定可以提供定义这种机制的起点。综上所述,近几年在circRNA研究中许多令人惊讶的发现已经被揭露出来,这个领域已经准备好揭露更多关于这些转录本是如何被调节和作用,以影响正常和疾病状态的见解。





赞