转自: 生信菜鸟团(微信公众号)
环状 RNA (circRNA)是一类由 mRNA 前体经反向可变剪切(back-splicing)而来、共价闭合且保守的单链转录本,通过 miRNA 海绵功能、干扰可变剪切、结合蛋白等方式调控来源基因及线性 mRNA 的表达。由于其特殊的拓扑结构及时空表达,成为近年来的研究热点。本篇主要梳理circRNA的研究开端、生物合成过程中所受的调控,下一篇将展开描述circRNA的表达及生物学功能。
研究历程
1976年,Sanger 等首次报道某些高等植物类病毒以共价闭合的环形分子形式存在。1986 年,Kos 等在动物体内发现环形分子HDV。而在当时的背景下,科学家只将其看作一种冗余的错误剪切产物。随后测序技术和生物信息学的发展,2012年,研究人员首次确认在人类中这些“冗余产物”是一类大量存在且具有转录后调控潜能的RNA分子。2014年,在拟南芥中也确认了circRNA的存在,由此拉开植物circRNA的研究序幕。
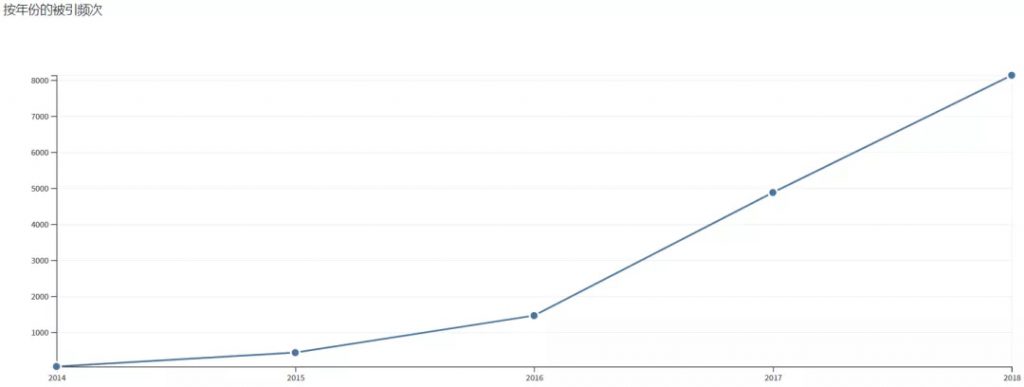
简而言之,早期研究主要解决由circRNA表达丰度普遍偏低带来的一系列问题,而近5年来的研究则集中于circRNA的生物表达、生物学功能及应用场景。下图展示近五年来的引文统计,统计来源于 web of science 。
合成模型
目前主流的circRNA形成模型主要有以下4种:
1. 反向可变剪切环化;
2. 内含子驱动反向互补序列形成环化;
3. 单个基因内不同内含子序列配对环化;
4. 受到RNA结合蛋白调控的外显子环化。
合成、降解过程调控
circRNA来源于mRNA前体可变剪切,由RNA聚合酶Pol II介导,因此该过程将受到如下调控:
1. Pol II对circRNA转录的影响
研究发现circRNA来源基因的Pol II转录延伸率(ranscription elongation rate, TER)高于non-circRNA基因,而TRE是决定剪接事件结果的一个重要因素。这可能是由于快速的延伸导致非连续的内含子互补序列配对,或者是来源基因的TER影响了可变反向剪接的位点选择,进而促进反向剪接。绝大多数circRNA的环化发生在mRNA前体转录完成后,同样受到Pol II对poly(A)信号识别的影响。
2. 调控子对反向剪切过程的影响
- 顺式作用元件
能够环化的外显子侧翼内含子序列中包含反向剪切的调控元件,例如在大多数的哺乳动物和蠕虫中都存在的 ICSs 或Alus,且短重复片段能够诱导表达载体上circRNA的形成。要注意的是,哺乳动物的重复片段进化具有偏好性,因此在低等生物中,侧翼内含子互补序列可能并不是circRNA形成的关键特征,可能存在其他的机制或者调控元件。
- 反式作用因子
多个RNA结合蛋白(RBPs)协助顺式作用元件调控circRNA的表达。Double-stranded RBPs (dsRBPs)通过结合瞬时稳定或者破坏RNA pairing参与调控。而不包含dsRBD的RBPs则通过结合特殊的RNA参与circRNA水平调控,例如剪切因子Quaking (QKI)、FUS、RNA-binding motif protein 20 (RBM20) 等。
- 剪切因子
除了上述两种调控子以外,实验证明,敲除剪切因子或者化学抑止剪切子活动时经典剪切会转变为反向剪切,但是这些剪切子如何参与调控反向剪切过程尚不明确。
由于circRNA不受核酸外切酶的影响,因此即使不充足的表达也能够积累较高的丰度,但是最终的降解机制尚不明确。研究显示,circRNA完全互补结合miRNA后能够通过Ago2调控的启动降解,但是大多数circRNA序列仅包含保守miRNA的部分互补结合位点;m6A修饰的circRNA经常来源于未被甲基化修饰的外显子,较甲基化修饰的mRNA其更稳定,m6A修饰调节也可能影响circRNA的半衰期。
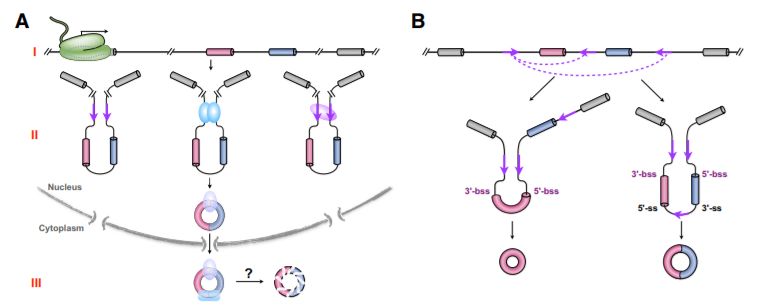
Figure 1. Regulation of circRNA Expression [2]
(A) Regulation of the steady-state level of circRNA expression. Endogenous circRNA expression is regulated at three major levels, including precursor RNA transcription (I), post- or co-transcriptional processing (II), and turnover (III). (B) The competition of ICSs leads to alternative back-splicing for multiple circRNAs in a single gene locus.
主要参考文献
[1] Chen L L. The biogenesis and emerging roles of circular RNAs[J]. Nat Rev Mol Cell Biol, 2016, 17(4):205-211.
[2] Li, X., Yang, L., & Chen, L. L. (2018). The biogenesis, functions, and challenges of circular RNAs. Molecular cell.



来第一个抢占沙发评论吧!