转自: 胞外囊泡与外泌体(微信公众号)
通过调节细胞之间的各种生物过程,外泌体已成为细胞间通讯的关键介质,无论是局部还是全身。环状RNA(circRNA)是内源性非编码RNA的新成员,具有广泛分布和多种细胞功能。最近,已经鉴定了环状RNA在外泌体中的富集和稳定性。7月5日郑州大学第一附属医院检验科与结直肠外科团队在Molecular Cancer点击查看影响因子上发表了“Exosomal circRNAs: biogenesis, effect and application in human diseases”,在这篇综述中,概述了外泌体circRNA的起源,生物发生和功能以及它们在各种疾病中的作用。尽管它们在基因调控中的确切作用和机制仍然很难实现,但外泌体内的circRNA具有作为疾病生物标志物和新治疗靶标的潜在应用。

通常,几乎所有细胞类型都释放富含血浆以及其他体液的外泌体,包括唾液,尿液,精液,痰和母乳。外泌体也由免疫和非免疫细胞产生,这些细胞在免疫调节中具有重要作用。此外,外泌体释放已被建议具有预后相关性;血清外泌体水平升高通常可预测不良后果。值得注意的是,Li首先通过RNA序列分析报道了与生产细胞相比,外泌体中丰富的circRNA的富集和稳定性。虽然对外泌体circRNA的研究目前正在获得动力,但外泌体circRNA的功能和特征仍然很不清楚。
除了癌症来源外,外泌体circRNA通常来源于活化的人血小板,与其他造血细胞相比,它更多地与止血,炎症和伤口愈合有关。有趣的是,赵表明外泌体circRNA可能负责神经元的生长和修复,神经信号的传递,以及重要信号通路的调节,特别是谷氨酸能突触和cGMP-PKG信号通路。因此,对外泌体circRNAs的进一步研究不仅对了解外泌体的功能和特征产生了深远的影响,而且为许多疾病诊断和靶向治疗提供了新的途径。
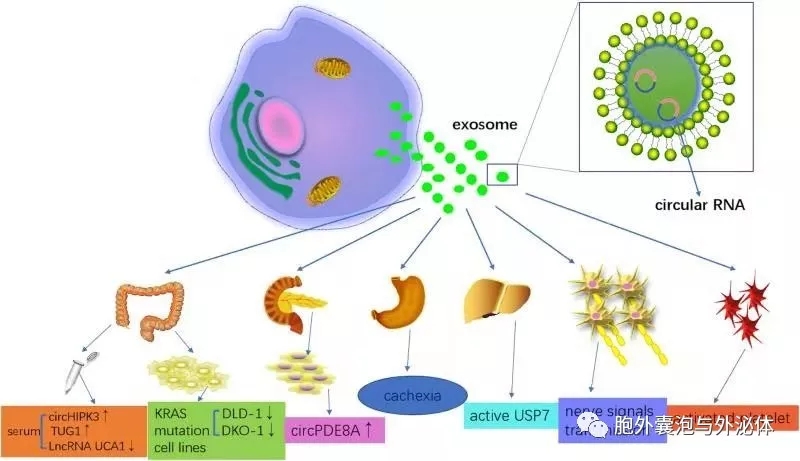
外泌体circRNA和增殖
失调的增殖是肿瘤转化中最重要的因素之一;因此,人们越来越关注对细胞周期调控机制的理解。在之前的报道中,miRNA与细胞周期的调节和肝细胞癌(HCC)细胞的增殖有关。有趣的是,对于亚砷酸盐转化的HaCat细胞,Dai报道外泌体circRNA_100284通过充当miR-217的海绵来调节细胞周期并通过诱导细胞周期的G2/M期停滞并靶向EZH2来抑制细胞增殖。然而,通过miR-217调节EZH2的潜在机制及其如何影响恶性转化仍需要进一步表征。
值得注意的是,最近的研究表明,亚砷酸盐转化细胞分泌的外泌体中circRNA水平增加。miR-217在正常细胞中的过表达降低了EZH2和clclin-D1的表达,后者调节细胞周期中G1至S期的转变。该证据表明,外泌体circRNA诱导加速的细胞周期并促进正常细胞的增殖。另外,从脂肪组织分泌的外泌体circRNA可以调节HCC中的去泛素化。此外,体内研究证明过表达的circ-DB显着下调miR-34a,导致miR-34a/USP7/CyclinA2信号通路的激活。因此,外泌体circRNA促进细胞生长并抑制对DNA的损伤。
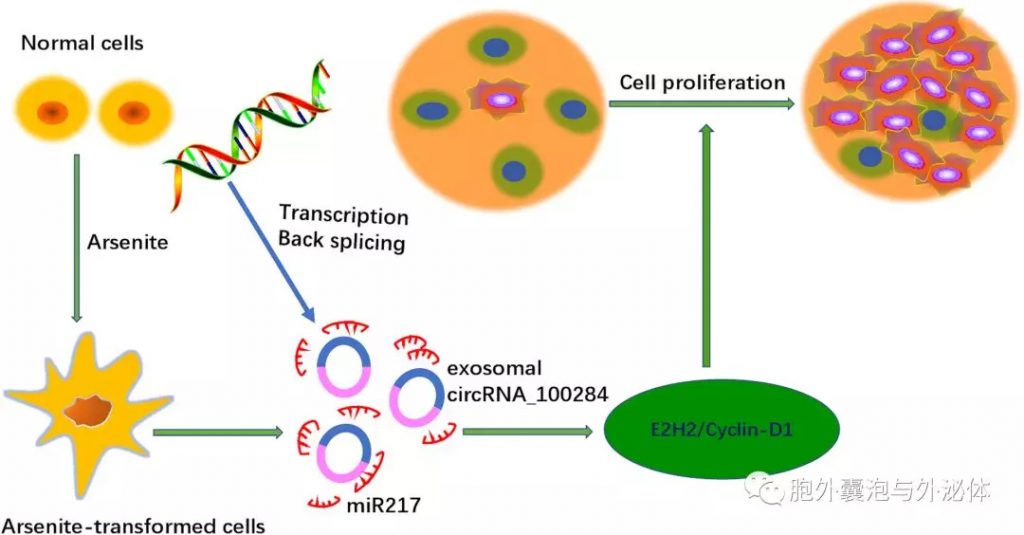
Figure 2:外泌体circRNA在细胞增殖中的作用的示意图。慢性接触亚砷酸盐会增加外泌体circRNA_100284水平,从而加速细胞周期并通过作用于miR217促进增殖。E2H2和细胞周期蛋白D1,有希望的增殖生物标志物,被广泛激活,以调节G1至S期的转变,从而诱导细胞增殖。
有趣的是,最近的一项研究表明,外泌体circRASSF2促进了喉鳞状细胞癌(LSCC)的进展。研究人员发现,与对照组相比,LSCC肿瘤组织中circRASSF2的表达显着且持续增加。此外,它们通过miR-302b-3p/IGF-1R轴抑制外泌体环-RASSF2显着抑制细胞增殖和迁移,表明外泌体circRNA在肿瘤细胞增殖中的重要性。
外泌体circRNA和转移
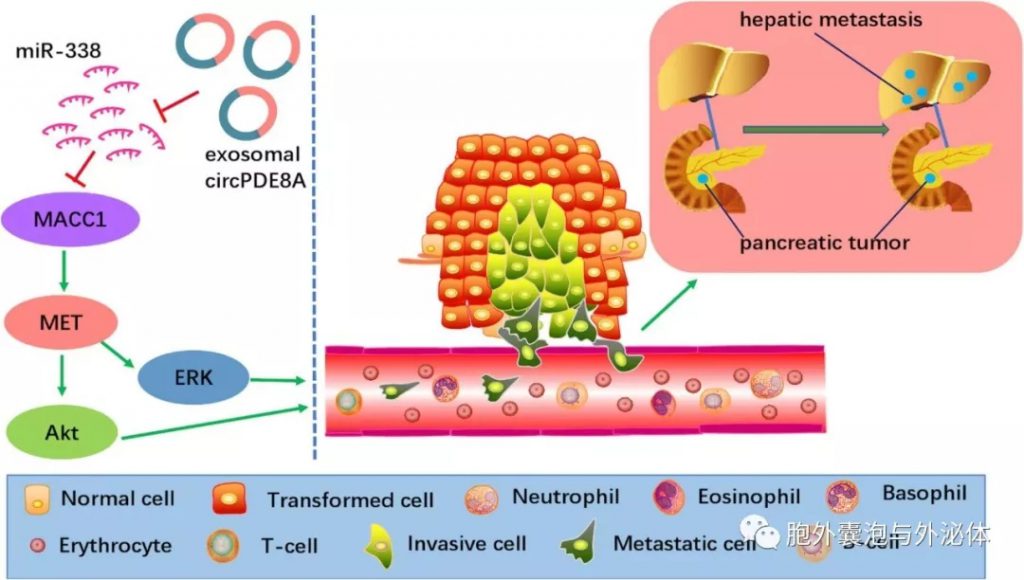
大量研究表明,肿瘤的发生和转移与许多致癌基因有关,并且涉及许多致癌途径。如今,越来越多的证据表明,癌细胞与细胞的通讯和周围的基质有助于转移。进一步的研究表明,circ-PDE8A通过上调MET促进肿瘤细胞生长,MET是一种酪氨酸激酶受体,是包括PDAC在内的上皮肿瘤子集的关键癌基因之一。此外,肿瘤排泄的circ-PDE8A可通过外泌体转运释放到血液循环中,作为miR-338的ceRNA,通过MACC/ MET/ERK或AKT途径调节MACC1并促进侵袭性转移。同样,最近的一项研究证实,circNRIP1可通过胃癌(GC)细胞之间的外泌体连接传递,外泌体circNRIP1海绵miR-149-5p可影响AKT1/ mTOR信号通路并促进胃癌的增殖,迁移和转移。同样,这种现象也在乳腺癌细胞和患者中被发现。这些新发现表明外泌体circRNA在肿瘤转移中的重要作用。
耐药性被认为是癌症患者治疗中的巨大障碍。由于各种潜在的机制与耐药性的进展有关,外泌体作为一种新的治疗途径已经吸引并获得普遍关注。重要的是,外泌体将多重耐药(MDR)相关蛋白和非编码RNA传递给靶细胞,包括circRNA。此外,血清外泌体-FECR1与SCLC患者的临床化疗和较差的存活率相关。这些证据表明外泌体circRNAs失调与耐药性之间可能存在关联。
越来越多的证据表明,上皮癌,如结肠直肠癌(CRC),优先对许多晚期药物治疗有抵抗力。表皮生长因子受体(EGFR)是HER-ErbB家族的成员,在CRC的增殖,血管生成,基因突变和耐药性中起重要作用。KRAS是一种细胞内信号分子,其突变在大约40%的结直肠肿瘤中发现。因此,鉴定受KRAS突变影响的关键信号传导途径有助于我们理解如何药理学靶向治疗。
有趣的是,在源自DLD-1 CRC细胞的外泌体中,circRTN4的丰度显着上调,其与DKs-8细胞相比具有KRAS突变。然而,在DLD-1和DKO-1细胞中,circRTN4的细胞内丰度显着下调,表明外泌体circRNA不依赖于细胞内circRNA,并且可以在外泌体和细胞质之间活跃地传递。这些发现为外泌体circRNA的功能提供了新的见解,并证明了它们调节化疗耐药性的能力。
临床应用
外泌体circRNA临床应用的新生时代正在迅速发展。新出现的证据表明,外泌体circRNA从各种细胞中释放出来,携带信号分子进行细胞通讯,甚至调节器官功能。此外,患者中外泌体circRNA的表达谱与健康组相区别,外泌体内的circRNA可能作为某些肿瘤的分子标记物起作用以支持诊断。外泌体circRNA也被认为是健康和患病状态的关键介质,并且可能成为特定条件的有希望的生物标志物。同样,外泌体环状RNA IARS表达高于胰腺癌组织和血浆外泌体中的对照组,该研究结果表明外泌体circRNA的存在可能是PDAC诊断和预后预测的有用标志物。
此外,外泌体衍生的miRNA和蛋白质组学材料可用作各种肿瘤的诊断指标,例如卵巢癌,前列腺癌和肺癌。与miRNA不同,circRNA非常稳定,具有细胞/组织特异性表达模式,这表明它们作为基因调节因子的潜在应用以及它们作为分子诊断和预后生物标记物的可能性。重要的是,circRNA对海绵miRNA和蛋白质的独特细胞稳定性和功能也可能表明circRNA是靶向药物递送的有前景的载体。尽管它具有巨大的潜力,但对外泌体circRNA的理解仍处于初期阶段。
有趣的是,根据Li在人血清外泌体中鉴定出1215个circRNA,超过90%的检测到的外显子由外显子组成,显示出高稳定性和保守的核酸外切酶切割,这表明circRNA可以从细胞主动转移到外泌体并指示肿瘤诊断标志物的潜在可能性。由于它们的适用性,特异性和可及性,外泌体circRNA具有细胞治疗的潜力以及来自外周血液,组织或骨髓来源的干细胞移植的肿瘤转化的理论关注。
尽管有上述令人鼓舞的进展,但临床应用中外泌体circRNA的挑战和困难存在于多个方面。首先,由于它们的丰度低,使用精确的方法和算法难以在外泌体中检测到circRNA。其次,圆形构象和序列与线性mRNA对应物重叠,使得对circRNA表达和功能的精确评估具有挑战性。用先进的技术,改进的实验方法和进一步的研究来解决这些问题是值得的。
最近的研究表明,外泌体circRNA可能对病理生理过程有重要影响。外泌体circRNA与癌症的联系已成为一个受欢迎的研究领域。但是,仍有一些问题需要解决。首先,缺乏对circRNA最终如何降解的理解。此外,在外泌体形成过程中circRNA如何富集的机制尚不清楚。一种可能性是circRNA在细胞质中丰富并且在其形成期间被动地包含在外泌体中。或者,circRNA可以从细胞质主动转移到外泌体中。研究造血系统中的外泌体circRNA,免疫反应,神经紊乱,癌症发展和其他生物环境和疾病的未来研究将进一步揭示外泌体circRNA的神秘面纱。因此,揭示癌症发病机制和寻找新的潜在诊断生物标志物或治疗靶标将成为未来的热门话题。
全文链接:https://pan.baidu.com/s/1lb2yvgQqVr6zmpV8fbF68A
提取码: mh87





来第一个抢占沙发评论吧!