CircRNAs以前被认为是剪接错误而产生的非编码产物,最近越来越多的证据表明circRNAs在真核细胞中广泛存在并具有多样性。由于circRNAs缺少可接触的末端,可以避免自身被核酸外切酶降解,因此其比线性RNA更加稳定。然而,circRNAs的形成机制和其细胞功能尚不清楚。CircRNAs作为非编码RNA的一员,具有独特的共价闭合环状结构,这使其区别于lncRNA和miRNA等非编码RNA,高通量测序技术已经检测到大量具有不同长度和类型的circRNAs,测序数据分析表明,它们在组织和发育阶段特异性表达,并在小鼠和人之间保守。最新研究表明circRNAs具有多种生物学功能,并在多种疾病中发挥潜在的重要作用。Vo等人发现在大于2000个肿瘤样本中,与邻近的正常组织相比,circRNA的总丰度普遍减少。
CircRNAs的分类
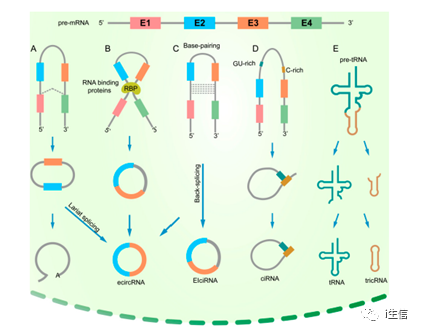
随着测序技术的发展,已经发现并鉴定了几种类型的circRNA,主要有4种亚型:外显子型circRNA(ecircRNAs),其主要来自单个或多个外显子;环状内含子型circRNA(cirRNAs),其只包含内含子;外显子-内含子型circRNAs(EIciRNAs),其由外显子和内含子组成;tRNA内含子型circRNA(tricRNAs),其是由pre-tRNA内含子经过剪接形成的。目前,大部分被鉴定的circRNAs属于ecircRNAs。
接下来我们以发表在Int. J. Mol. Sci上的这篇“CircularRNAs: Biogenesis, Mechanism, and Function in Human Cancers”review来介绍下circRNAs。
如下图1A是套索驱动的环化,当pre-mRNA被剪接的时候,上游外显子的剪接受体和下游供体相互接近产生一个包含外显子和内含子的套索结构,套索结构中的内含子被移除之后,外显子通过磷酸二酯键连接形成ecircRNAs。
图1B是RNA结合蛋白(RBP)驱动的环化,RBPs能够促进上游内含子和下游内含子的相互作用,最终产生ecircRNA。
图1C是碱基配对驱动的环化,上游内含子和下游内含子基于反向重复和互补的序列互补配对,内含子去除或者保留分别形成ecircRNA或EIciRNA。
图1D是ciRNA的形成,ciRNA的形成主要依赖于一个7nt的GU富集元件和一个11nt的C富集元件来使其避免脱支和被核酸外切酶降解。图D是tricRNA.的形成,tRNA剪切酶将pre-tRNA分割成两部分,其中一部分通过3’-5’磷酸二酯键形成tricRNAs,另一部分产生tRNAs
图1
CircRNAs的功能机制
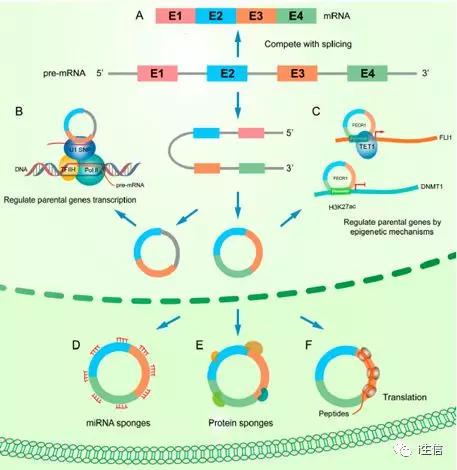
CircRNAs在人类癌症中的机制是多种多样的,包括作为miRNA sponges,与蛋白质相互作用,调节基因的剪接或转录,翻译成蛋白质或小肽和表观遗传调控。根据circRNAs的靶基因可以分为两种类型:一类是调节其宿主基因,另一类是靶向其他的基因。
目前circRNAs研究的主流方向有circRNAs作为miRNA sponges,或翻译成短肽发挥其功能。
如图2D中circRNAs可以通过吸附miRNAs来影响其和其靶基因的表达,例如circ HIPK3可以吸附miR-7,进而可以reverse由miR-7靶向的原癌基因(EGFR、YY1、FAK、IGF1R)从而促进了结直肠癌的进程。
随着深度核糖体测序和质谱等技术的发展,最近许多研究鉴定并证实了一些非编码RNA(包括circRNAs)能够编码蛋白或小肽,如图2F所示,比如LINC-PINT起源的circRNA能够编码出具有87个aa的短肽,短肽可以直接和聚合酶相关因子复合体(PAF1c)相互作用,从而抑制多种癌基因的转录延伸。再如circRNA FBXW7也可以编码与肿瘤相关的蛋白FBXW7-185aa,FBXW7-185aa可以拮抗usp28诱导的c-myc蛋白的稳定性,从而降低c-myc蛋白的半衰期;circ-SHPRH编码的短肽SHPRH-146aa可以介导PCNA的泛素化和降解。
CircRNAs还可以参与表观遗传调控和蛋白翻译后调控。例如图2C中是由FLI1基因起源的circRNA FECR1能够和FLI1的promoter相互作用,并通过招募去甲基化酶TET1,使FLI1基因CpG岛区域产生广泛的去甲基化作用,同时circRNA FECR1可以结合于DNMT1基因的H3K27Ac富集的promoter区,进而反式抑制甲基转移酶DNMT1基因的表达。图2E所示,circRNAs可以通过结合蛋白来调节它们的活性或影响其表达,如circ-FOXO3可以结合MDM2和P53,circ-FOXO3结合MDM2后可以增强其对p53的多聚泛素化作用,进而使p53通过蛋白酶体途径降解。
除此之外,circRNAs还可以调节其宿主基因的表达,如下图2A所示,circRNA的形成可以与线性RNA的剪接竞争其共同的pre-mRNA,从而可以影响线性RNA的丰度;图2B是包含有内含子的circRNAs,ciRNAs和EIciRNAs能够通过RNA-RNA相互作用与U1 snRNP结合,然后进一步和Pol II转录复合体相互作用来增强其母本基因的表达。
图2
随着测序技术和生信方法的不断进步,对circRNAs 的研究较之前已经有了较快的发展,但我们对circRNAs的认识仅仅只是冰山一角,还有许多问题需要我们继续去探索,包括机体是如何执行精确的经典剪接或反向剪接的,circRNAs的核质转运是如何被调控的,cricRNAs最终是如何被降解的等等问题。
最后推荐给大家几篇circRNAs领域有代表性的文章及综述:
1. Past, present, and future ofcircRNAs. EMBO
2. Circular RNAs: Biogenesis,Mechanism, and Function in Human Cancers.Int. J. Mol. Sci.
3. CircRNA biogenesis competes withpre-mRNA splicing. Mol.Cell
4. CircHIPK3 promotes colorectalcancer growth and metastasis by sponging miR-7. CellDeath Dis
5. Induction of tumor apoptosisthrough a circular RNA enhancing Foxo3 activity. Cell Death andDifferentiation
6. Novel Role of FBXW7 Circular RNAin Repressing Glioma Tumorigenesis.JNatl Cancer Inst.
7. Translation of CircRNAs. Mol.Cell




来第一个抢占沙发评论吧!