|
国际疼痛研究协会将神经病理性疼痛(Neuropathic Pain ,N P P)定义为由神经系统原发性损害和功能障碍所激发或引起的疼痛,2011年IASP官方学术期刊PAIN明确确定了NeuP(神经病理性痛)的新定义:由躯体感觉神经系统的损伤或疾病而直接造成的疼痛(pain arising as a direct consequence of a lesion or disease affecting the somatosensory system)。它属于一种慢性疼痛,疼痛表现为自发性疼痛、痛觉过敏、异常疼痛和感觉异常等临床特征。
外周神经损伤往往会引起中枢敏化,这种敏化来源于兴奋性氨基酸的释放,从而激活 NMDA受体(N-甲基-D-天冬氨酸受体,离子型谷氨酸受体的一个亚型)和非 NMDA 受体。NMDA 受体的激活会导致神经元长时期的兴奋性改变,引起突触活动频率的持续增高,表现为自发性和诱发性神经元放电增多和感受野扩大,产生持续存在,难以治愈的神经病理性疼痛。既往研究表明炎症应答、内源性阿片肽、神经营养因子等参与慢性疼痛的发生发展,但具体机制依然不清[1]。
环状RNA(circRNA)是一类环状非编码RNA,在中枢神经系统中有丰富的表达,且相比于线性RNA更为稳定,是近来发现的基因表达调控新方式,参与调节多种生理和病理过程。然而神经系统中的circRNA是否在神经病理性疼痛中扮演重要角色,既往研究较少[2]。
2019年9月11日,《Nature Communications》杂志在线发表了中山大学中山医学院信文君教授团队与中山大学孙逸仙纪念医院马超教授团队共同合作题为“CircAnks1a in the spinal cord regulates hypersensitivity in a rodent model of neuropathic pain”的研究论文[3]。该研究揭示了脊髓背角特异性高表达的circAnks1a调控投射神经元兴奋性并介导神经损伤诱导的神经病理性疼痛的新机制。为病理性疼痛的治疗提供了新的靶点。
结果
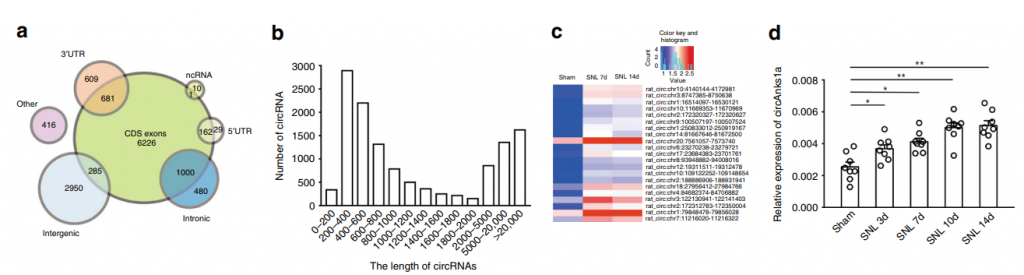
为了鉴定出参与病理性疼痛的circRNA,作者通过大鼠建立了SNL慢性疼痛模型,取材脊髓背角组织进行circRNA测序,发现21个circRNA在SNL 7天及14天均显著上调,进一步通过circRNA的特异性引物进行qPCR验证,证实SNL诱导慢痛模型中,circAnks1a的上调最为显著。同时发现,相比于其他组织及不同脊髓节段,circAnks1a在L4-L6脊髓背角神经元中特异性高表达,在胞核与胞浆中均有表达(图1)。
图1 脊髓背角中circRNA测序与鉴定
2. circAnks1a在神经损伤诱导的病理性疼痛中的作用
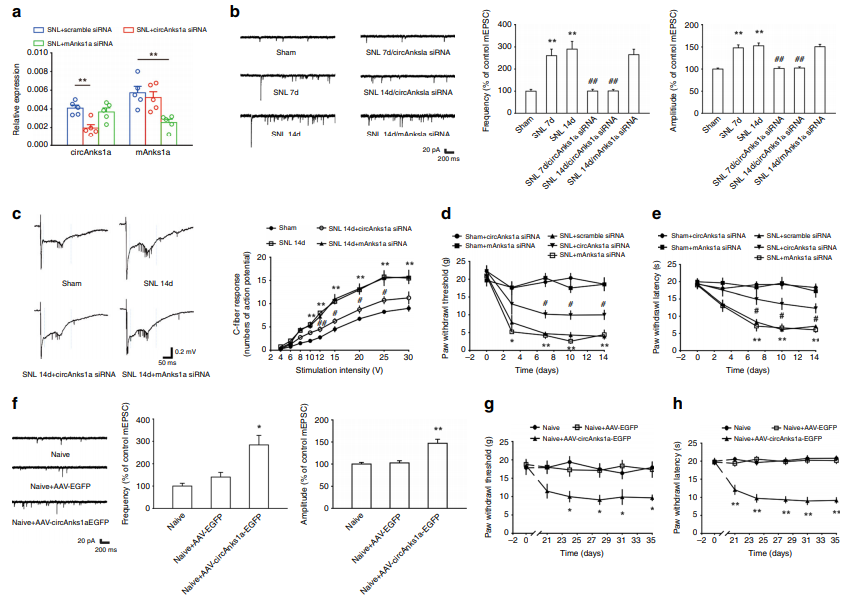
为了证明circAnks1a是否参与了神经损伤诱导的病理性疼痛,作者首先通过siRNA对circAnks1a进行干扰,并检测了大鼠的机械痛和热痛行为学,以及一些列电生理数据,例如mEPSC、C纤维诱发的动作电位等。结果表明,当circAnks1a的水平被抑制后,SNL诱导的大鼠机械性撤足阈值及热撤足潜伏期显著增大,神经元兴奋性减弱。而当预先在脊髓背角局部注射circAnks1a过表达病毒后,大鼠脊髓背角神经元的mEPSC的频率与幅度明显增强,同时诱发出痛觉过敏(图2)。
图2 circAnks1a在神经损伤诱导的病理性疼痛中的作用
3. circAnks1a通过影响VEGFB的表达介导疼痛
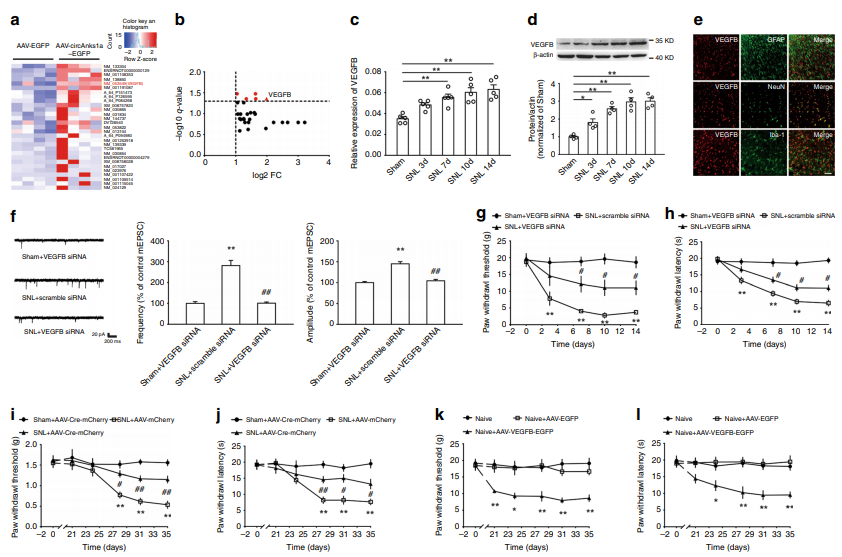
为了进一步探究circAnks1a是通过何种下游蛋白发挥作用,作者过表达circAnks1a后,分析过表达前后变化显著的基因,发现circAnks1a的过表达引起了脊髓背角中VEGFB的显著上调。qPCR与WB进一步证实了circAnks1a对VEGFB的调控作用。免疫荧光显示,circAnks1a与VEGFB在脊髓背角神经元中具有相同的细胞定位。通过病毒载体、VEGFBflox/flox条件性敲除小鼠等进行功能实验发现,VEGFB在神经损伤诱导的病理性疼痛中发挥重要作用(图3)。
图3 circAnks1a通过影响VEGFB的表达介导疼痛
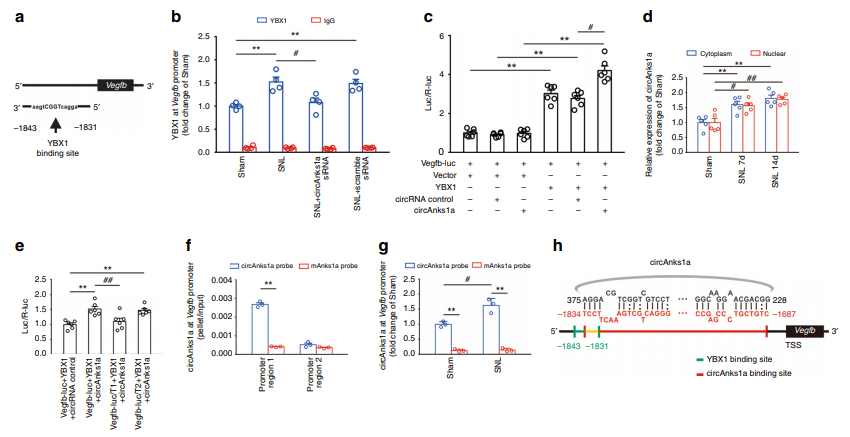
4. circAnks1a促进YBX1的核内转运
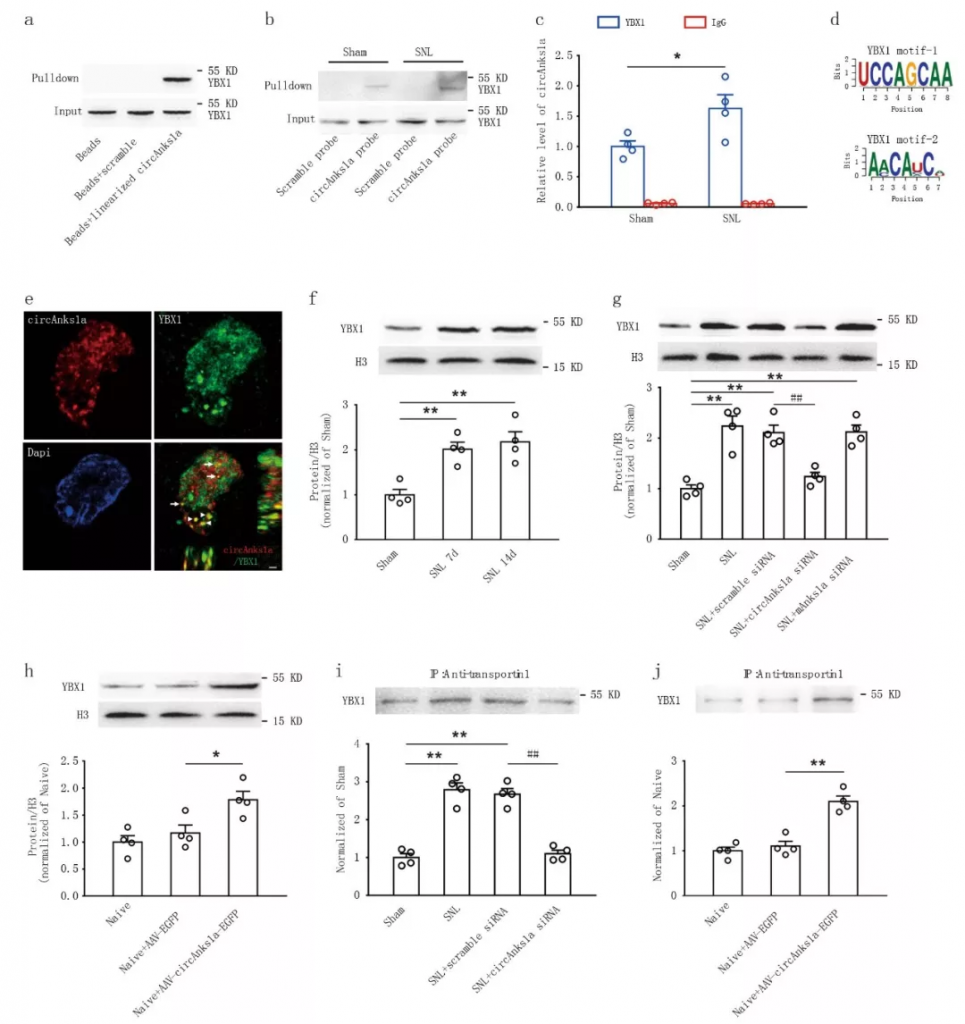
为了探究circAnks1a调控VEGFB表达的具体机制。作者通过RNA pulldown联合LC/MS以及RIP等实验发现circAnks1a与YBX1有显著结合,并且进一步通过co-IP等实验发现circAnks1a可以通过影响YBX1与转运蛋白transportin1的结合进而影响YBX1的核内转运(图4)。
图4 circAnks1a促进YBX1的核内转运
5. circAnks1a增强了YBX1在Vegfb启动子区的募集增强Vegfb的转录
YBX1作为转录因子,在Vegfb启动子区有特异性的结合位点。ChIP实验证实YBX1在Vegfb启动子区的结合在疼痛模型中显著增强,而干扰了circAnks1a后,结合下调。双萤光素酶报告基因实验也发现,同时过表达YBX1与circAnks1a后,Vegfb的转录活性显著增强。进一步研究发现,circAnks1a与Vegfb启动子区的直接结合,促进了YBX1在Vegfb启动子区的募集,进而增强了Vegfb的转录(图5)。
图5 circAnks1a增强了YBX1在Vegfb启动子区的募集增强Vegfb的转录
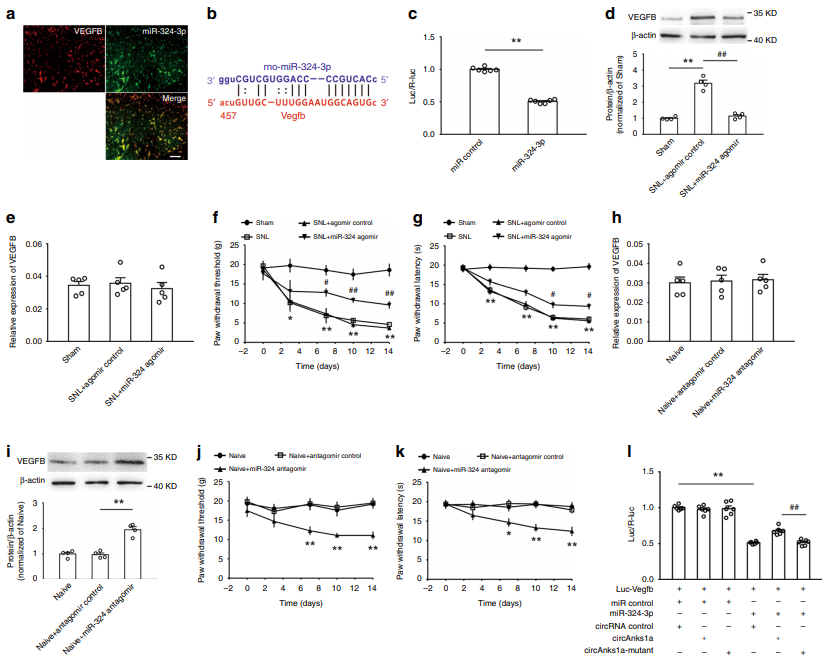
6. circAnks1a通过吸附miR-324-3p解除了对VEGFB翻译的抑制
作者研究发现,胞浆中的circAnks1a还具备吸附miRNA的能力,通过筛选,最终确定了miR-324-3p,预测发现,circAnks1a对miR-324-3p有三个潜在的结合位点,同时,miR-324-3p也可以作用于VEGFB mRNA的3‘ UTR区。干预miR-324-3p的水平后,可以显著调控VEGFB的表达,同时影响疼痛行为。(图6)。
图6 circAnks1a通过吸附miR-324-3p解除了对VEGFB翻译的抑制
小结:
本篇文章借助转基因小鼠、病毒载体介导的过表达和感染、分子生物学以及电生理等技术手段研究发现,神经损伤介导的病理性疼痛大鼠脊髓背角circAnks1a显著上调, circAnks1a通过转录水平及转录后水平调控VEGFB的表达,进而介导神经损伤诱导的中枢敏化及疼痛行为。为circRNA在神经系统的研究提供了借鉴。和元上海有幸提供实验中使用的AAV病毒载体,用实际行动助力中国脑科学的发展。
作者介绍
信文君教授,中山大学中山医学院生理教研室主任,珠江学者特聘教授,教育部新世纪优秀人才,广东省神经科学学会理事长,中山大学疼痛研究中心副主任。2004年博士毕业于中山大学中山医学院,2009年结束美国MD Anderson Cancer Center的博士后研究工作后在中山大学任职至今。主要研究领域为慢性疼痛的机制及痛性抑郁的相关研究,先后主持18项国家级/省级科研基金,发表SCI论文50余篇,其中2018年最新研究作为封面文章发表在《Science Signaling》。
马超教授,中山大学与香港理工大学联合培养博士、教授、主任医师、中山大学附属第二医院康复医学科主任。主持国家自然科学基金2项,省级科研基金3项,参与国家级和省部级基金5项,参与编写教材及专著10余本。以第一作者发表论著20余篇,其被SCI收录7篇。从医20年,致力于软组织疼痛及颈腰关节疼痛疾患和椎间盘突出症的基础、临床研究以及康复治疗。
徐婷,中山大学中山医学院特聘副研究员。2017年博士毕业于中山大学,此后在中山大学中山医学院从事研究工作至今。主要研究领域为慢性疼痛及镇痛的外周与中枢机制,先后共主持3项国家级/省级科研基金,以第一或共同第一作者发表多篇SCI论文(IF>6.0)。








来第一个抢占沙发评论吧!