原创:刘康|组织工程与干细胞研究所
circRNAs是一种内源性非编码RNA,其特征是在5′-端和3′-端之间有一个连续的共价闭合环,circRNAs的环状结构决定了其在不同物种中的稳定存在和高丰度。近年来circRNAs被发现在多种分子机制中发挥作用,如作为microRNA海绵、翻译蛋白和结合RNA结合蛋白等。其中miRNA海绵是circRNA在肿瘤的发生发展中最常见的作用。尽管在胃癌中已有几种circRNA被报道,但很少有肿瘤转移相关的circRNA及其功能和分子机制被报道。
今天介绍的文章是上海交通大学黄陈教授发表在Molecular Cancer上的一篇文章,作者通过对未转移胃癌组织和转移胃癌组织进行全转录组测序,鉴定了一个新的与转移相关的CircRNA CircNHSL1,并且发现circNHSL1在胃癌通过miR-1306-3p/SIX1/viment信号轴起着致癌基因的作用,可能成为胃癌患者治疗的新的诊断标志物和靶点。
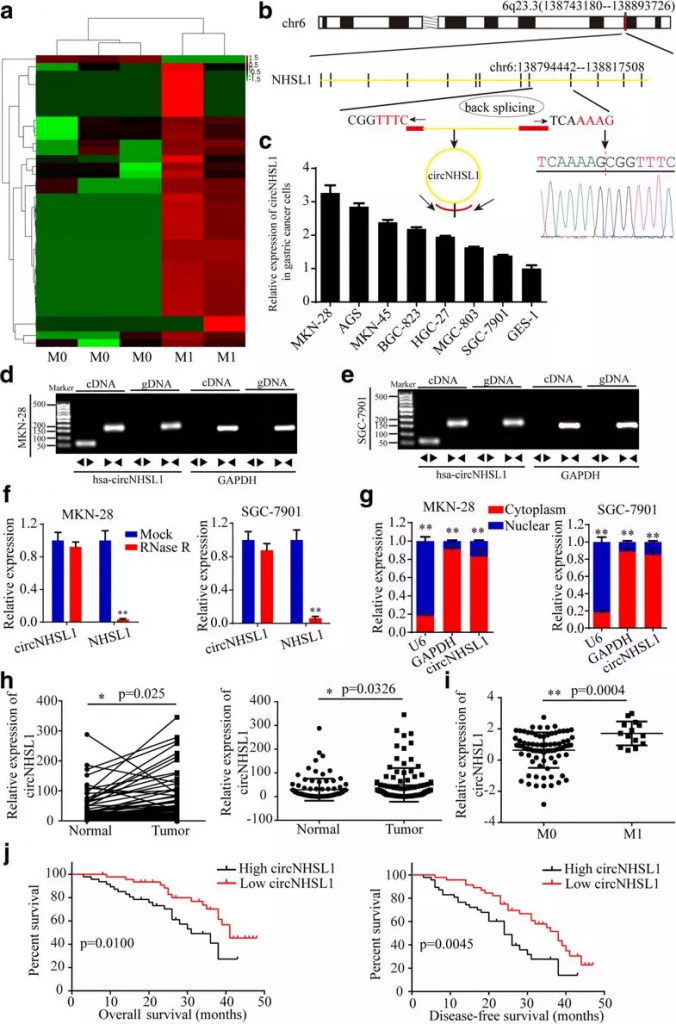
1. circNHSL1在胃癌组织中上调,并与胃癌进展和预后不良相关
作者通过对3例未转移胃癌组织和2例转移胃癌组织进行全转录组测序,筛选出37个在转移胃癌组织中显著上调的circRNA,1个下调circRNA(Fig 1a)。在前10位上调标的circRNA中,circNHSL1是上调最高的circRNA,通过Sanger测序证实了头部到尾部的剪接(Fig 1b)。为了检测circNHSL1和NHSL1的水平,作者设计了两套引物,分别扩增线性NHSL1和环状的circNHSL1。结果发现多发性胃癌细胞中circNHSL1的水平明显高于GES-1(人胃粘膜上皮细胞)细胞(图1c)。在这些胃癌细胞系中,MKN-28和AGS细胞的circNHSL1水平最高,SGC-7901和MGC-803细胞的circNHSL1水平最低(图1c)。为了检测circNHSL1的头尾剪接是由反式剪接还是基因组重排引起的,作者从MKN-28和SGC-7901细胞中提取了cDNA和gDNA。凝胶电泳结果表明,circNHSL1仅在cDNA中检测,而不是在gDNA(Fig 1d和e)中检测到,表明circNHSL1的环结构来自反向剪接。为了证实circNHSL1细胞的稳定性,MKN-28和SGC-7901细胞被一种3′-5’外核糖核酸酶RNase R处理。如图1f所示,circNHSL1抵抗RNase R的消化,但NHSL1的线性形式被急剧消化。此外,核质分离结果表明,circNHSL1主要位于细胞质中(Fig 1g)。这些结果表明circNHSL1在胃癌细胞浆中高度稳定,提示其可能成为一个合适的诊断或预后标志物。
随后作者对93对冰冻的胃癌组织及正常组织进行qPCR定量,发现癌症组织中circNHSL1表达显著升高(Fig 1h),并且M1期胃癌组织中的表达显著高于M0期(Fig 1i),通过Kaplan-Meier生存分析发现,高表达circNHSL1的病人的总体生存期及无病生存期显著低于低表达病人(Fig 1j)。
Fig 1 circNHSL1在胃癌组织中上调,并与疾病进程和预后不良相关
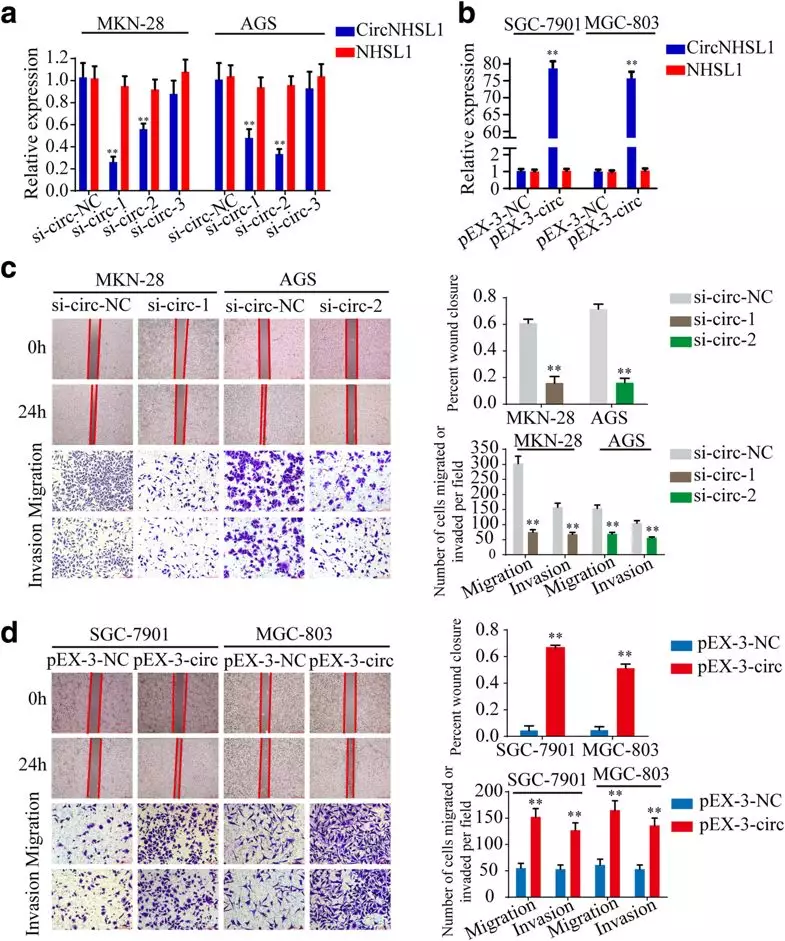
2. circNHSL1体外促进胃癌细胞的迁移和侵袭
作者在高表达circNHSL1的胃癌细胞系(MKN-28 和 AGS)中敲降circNHSL1(Fig 2a),在低表达的胃癌细胞系(SGC-7901和MGC-803)中过表达circNHSL1(Fig 2b),通过wound healing和transwell实验,发现敲降circNHSL1后,胃癌细胞的迁移、侵袭能力显著降低(Fig 2c),过表达后呈现相反的结果(Fig 2d),这说明circNHSL1在体外能够促进胃癌细胞的迁移和侵袭。
Fig2 circNHSL1体外促进胃癌细胞的迁移和侵袭
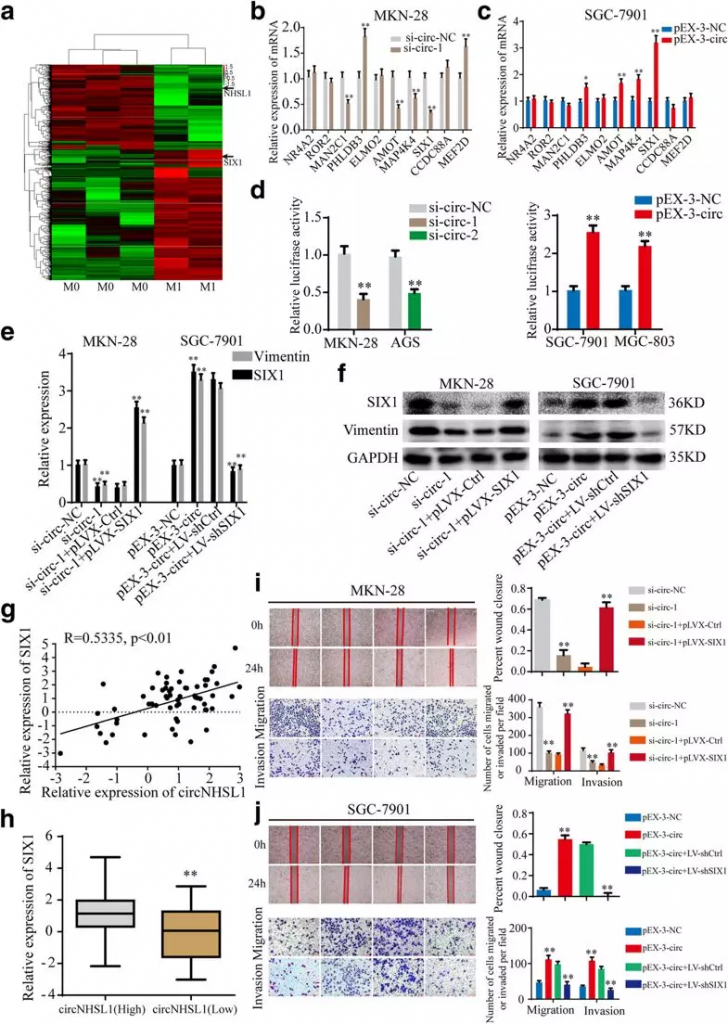
3. circNHSL1通过SIX1基因促进胃癌的进展
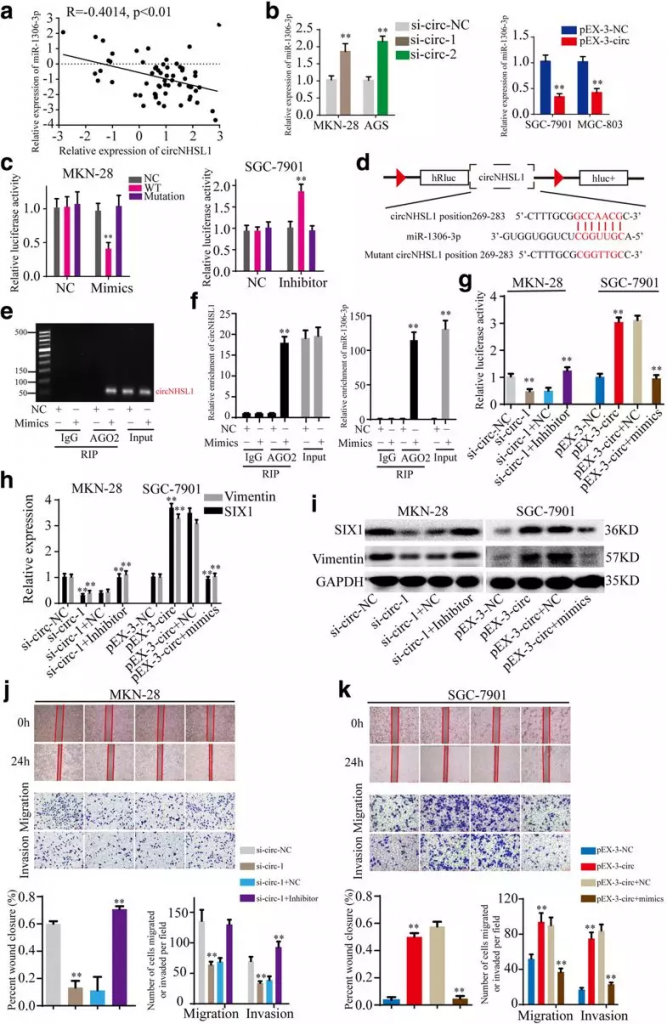
根据竞争性内源性RNA(ceRNA)假说,circRNAs可能通过响应miRNAs促进靶基因的表达。由于circNHSL1位于细胞质中,具有高度的稳定性,作者推测circNHSL1可以作为miRNA海绵来增加靶基因的表达。为了发现与circNHSL1表达呈正相关的基因,作者对3例无转移胃癌组织和2例有转移胃癌组织进行了RNA-seq检测,从而筛选到胃癌转移相关的mRNA,选取其中top10的上调基因进行验证(Fig 3a)。MAP4K4和SIX1的表达同时在两个敲降circNHSL1的细胞系中显著下调(Fig 3b,d),而AMOT和SIX1同时在两个过表达circNHSL1的细胞系中显著上调(fig 3c,d)。因此,作者假设circNHSL1正调控SIX1的表达。为了证实这一假设,作者构建了一个野生型SIX1 mRNA 3′-utr的荧光素酶报告质粒,并进行了荧光素酶报告检测。CircNHSL1沉默显著降低荧光素酶活性,而CircNHSL1过度表达明显提高荧光素酶活性。并且发现胃癌组织中SIX1与circNHSL1的表达呈正相关(Fig 3g,h)。他们通过挽救实验,即在敲降circNHSL1的同时过表达SIX1,以及过表达circNHSL1的同时敲降SIX1(Fig 3e,f),发现SIX1可以挽救circNHSL1表达量改变导致的细胞表型(Fig 3i,j),这说明circNHSL1通过SIX1促进胃癌的进程。
Fig3 circNHSL1通过SIX1基因促进胃癌的进展
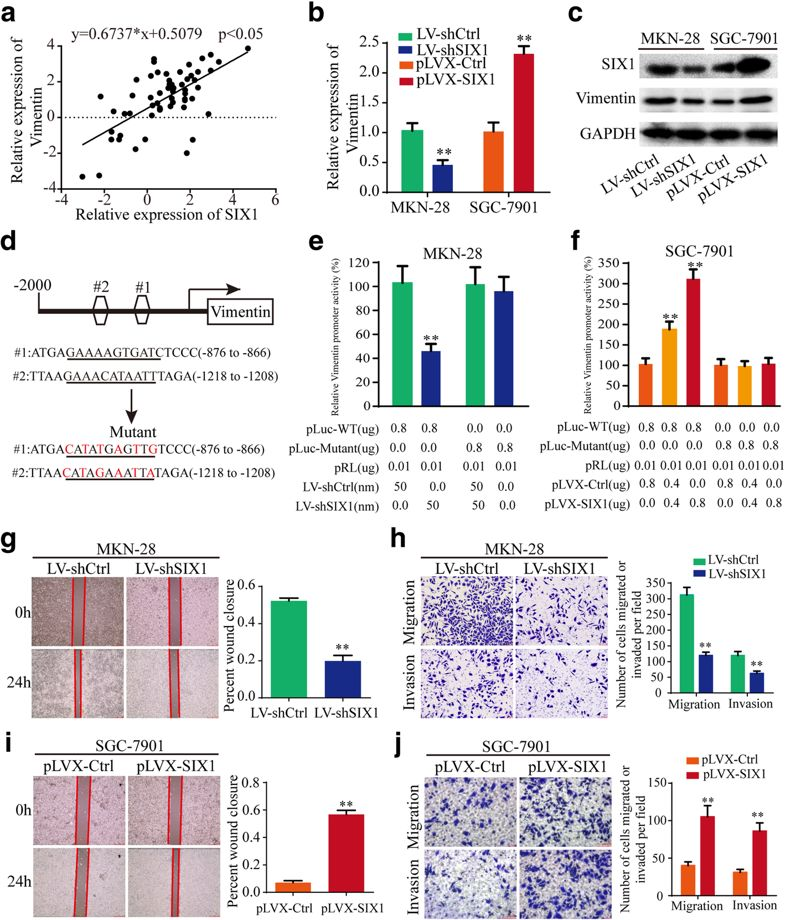
4. SIX1通过转录调节Vimentin促进胃癌进展
SIX1作为同源异型框基因家族的转录因子,可以在转录水平上调控靶基因的表达,从而发挥生物学功能。作者通过软件预测了SIX的靶基因,发现在Vimentin基因启动子上存在两个潜在的SIX结合位点(Fig 4d),而Vimentin是一种与肿瘤转移相关的蛋白。作者随后在胃癌组织中发现两者的表达量呈正相关(Fig 4a),敲降或过表达SIX1在mRNA及蛋白水平上改变了Vimentin的表达(Fig 4b, c)。最后作者通过荧光素酶报告实验验证了SIX1与Vimentin的启动子存在相互作用。然后,作者检测了SIX1在胃癌细胞中的功能。结果表明,SIX1促进了胃癌细胞的迁移和侵袭(Fig 4g-j)。总之,SIX1通过在转录水平上调节Vimentin的表达促进胃癌的进展。
Fig4 SIX1通过转录调节Vimentin促进胃癌进展
5. circNHSL1作为ceRNA,与SIX1竞争结合miR-1306-3p
已有研究表明,circRNAs可以作为miRNA海绵来消除miRNA的功能。在接下来的研究中,作者探讨了circNHSL1是否通过应答miRNAs促进胃癌的进展。作者通过数据库预测发现circNHSL1与SIX1具有共同的miR-1306-3p结合元件且预测得分高,因此以miR-1306-3p为对象,研究circNHSL1调控的ceRNA网络。在胃癌组织中,作者发现miR-1306-3p的表达量与circNHSL1呈负相关(Fig 5a),在胃癌细胞中敲降或过表达circNHSL1会导致miR-1306-3p的表达上升或下降(Fig 5b)。随后,作者通过荧光素酶报告实验(Fig 5c,d),以及anti-AGO2RIP实验(Fig 5e, f),验证了circNHSL1与miR-1306-3p之间存在直接的互作关系。为了验证miR-1306-3p在胃癌进程中起到的作用,作者又通过miR-1306-3p的抑制剂和mimics进行了挽救实验,发现miR-1306-3p能够挽救circNHSL1对胃癌细胞的作用(Fig 5h-k)。
Fig 5 circNHSL1作为ceRNA,与SIX1竞争结合miR-1306-3p
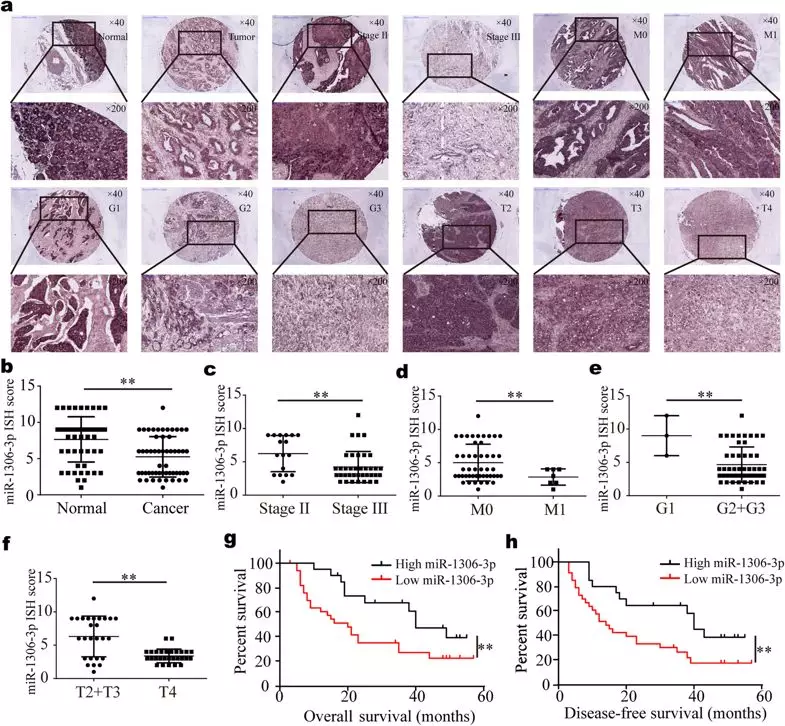
6. miR-1306-3p在胃癌组织中表达下调,并且与胃癌的进展及预后不良有关
作者通过原位杂交技术检测了miR-1306-3p在胃癌组织及其配对正常组织中的表达(Fig 6a),发现相较于正常组织,其在胃癌组织的表达出现下调(Fig. 6b),并且与胃癌TNM分期、分化程度具有显著的关系(Fig. 6c-f),经Kaplan-Meier生存分析,发现低表达miR-1306-3p的患者预后较高表达miR-1306-3p的患者差(Fig. 6g, h)。
Fig 6 miR-1306-3p在胃癌组织中表达下调,并且与胃癌的进展及预后不良有关
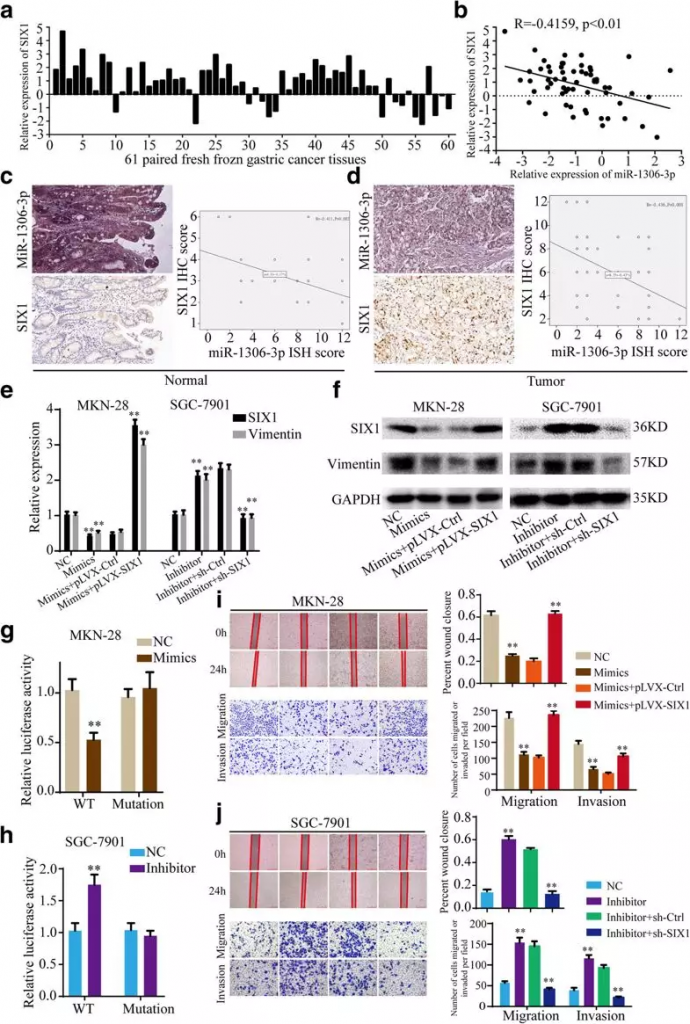
7. SIX1是miR-1306-3p的直接靶点
根据targetscan数据库,SXI1 mRNA含有miR-1306-3p的MRE,这意味着miR-1306-3p可能直接作用于SIX1。作者分析了胃癌组织中miR-1306-3p和SIX1的表达,发现SIX1在胃癌组织中表达上调(Fig 7a),miR-1306-3p水平与SIX1水平呈负相关(Fig 7b)。此外,miR-1306-3p的过度表达显著降低了MKN-28和SGC-7901细胞中SIX1 mRNA和蛋白质的表达,而miR-1306-3p的下调显著增加了SIX1的表达(Fig 7e, f)。荧光素酶报告分析显示miR-1306-3p模拟物显著降低了wt细胞的荧光素酶活性,而mir-1306-3p抑制剂显著提高了MKN-28和SGC-7901细胞的荧光素酶活性(Fig 7g, h)。这些数据表明miR-1306-3p通过直接结合SIX1 mRNA的3′-utr抑制SIX1的表达。
Fig 7 SIX1是miR-1306-3p的直接靶点
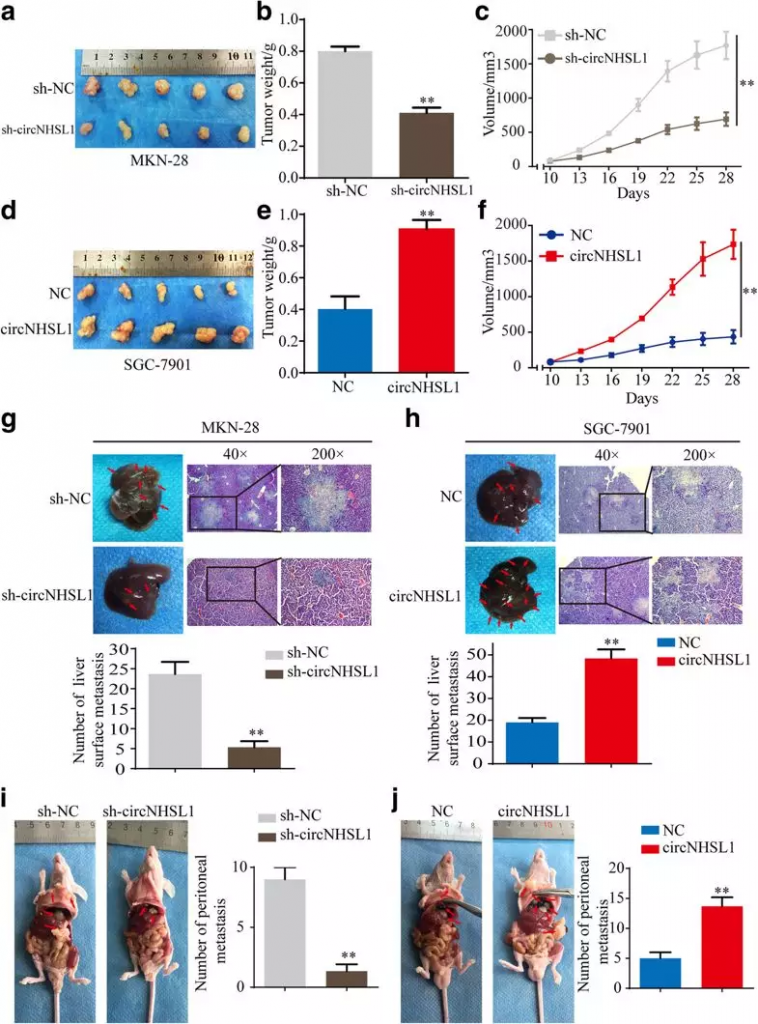
8. circNHSL1促进胃癌细胞在体内的生长和转移
作者通过异种移植,在小鼠皮下注射敲降或过表达circNHSL1的胃癌细胞,发现敲降circNHSL1的胃癌细胞在小鼠体内生长的体积和质量显著降低(Fig. 8a-c),而过表达circNHSL1的胃癌细胞呈现相反的表型(Fig. 8d-f)。此外,作者通过体内肝转移和腹膜转移实验,证实了circNHSL1能够促进胃癌细胞在小鼠的肝及腹膜中的转移(Fig 8g-j)。
Fig 8 circNHSL1促进胃癌细胞在体内的生长和转移
总之,作者通过全转录组测序技术,发现了一种与胃癌转移相关的新型circRNA——circNHSL1,其在胃癌组织中高表达,且与患者的预后不良相关。通过体内外功能研究验证了circNHSL1能够促进胃癌细胞的侵袭和转移,促进胃癌进程。经过一系列的机制研究,作者阐明了circNHSL1可以作为一种竞争内源性RNA(ceRNA),通过与SIX1竞争结合miR-1306-3p,间接调控SIX1的表达水平,从而调控胃癌进程。同时,研究发现circNHSL1和miR-1306-3p均有望成为胃癌预后的biomarker,为胃癌的诊断和治疗提供了新的分子靶点。
原文链接:https://link.springer.com/article/10.1186/s12943-019-1054-7





来第一个抢占沙发评论吧!