High-throughput RNA sequencing from paired lesional- and non-lesional skin reveals major alterations in the psoriasis circRNAome
配对损伤和非损伤皮肤的高通量RNA测序揭示了银屑病circRNA的主要变化
期刊:BMC Medical Genomics (IF=3.35)
发表单位:奥尔胡斯大学
导 读
本篇研究首次描述了来自银屑病患者的circRNA表达谱。除了使用RNA-seq,还使用NanoString nCounter技术分析银屑病中miRNA的表达(一种无需反转录酶的技术)。结合二者,作者描述了以下内容:
(1)正常和患病皮肤中circRNA的全局表达特征,及鉴定差异表达的circRNA;
(2)探索影响患病皮肤中circRNA表达值普遍下调的原因;
(3)正常和患病皮肤中miRNA的表达特征、差异表达miRNA及circRNA-miRNA关系。
摘 要
背景:银屑病是一种慢性炎症性皮肤病,其特征在于角质形成细胞过度增殖和异常分化。环状RNA(circRNA)是一种非编码RNA类型,具有与其异常稳定性相关的多种细胞功能。miRNA是在银屑病的发病机理中起作用的一组RNA,某些circRNA可以结合和调节microRNA(miRNA)。该项研究的目的是表征银屑病中的circRNA,并评估与miRNA表达模式的潜在相关性。
方法:使用高通量RNA测序(RNA-seq),NanoString技术和RNA原位杂交(CISH)分析银屑病患者皮损和非皮损成对皮肤中circRNA的表达。同时使用NanoString技术对799个miRNA进行了分析,并使用激光捕获显微切割技术分别研究了真皮和表皮。
结果:发现与正常皮肤相比,病变皮肤中circRNA表达明显下调。通过分析激光捕获显微切割的组织观察到主要存在于表皮。大多数circRNA均独立于其相应的线性宿主基因而被下调。在银屑病中观察到的circRNA下调既不是由于已知影响circRNA生物发生的因子的表达水平改变,也不是由于病变皮肤中炎症细胞(例如淋巴细胞)的数量增加。病变皮肤和正常皮肤之间circRNA上可用miRNA结合位点的总体差异与miRNA表达模式的差异无关。
结论:这是对银屑病患者的成对病变和非病变皮肤进行的首次全基因组circRNA分析,并揭示了病变样品中circRNA含量的降低。疾病的原因还是仍有待揭露,没有找到证据证明circRNA上miRNA结合位点的丢失可以解释病变皮肤和非病变皮肤之间miRNA表达的差异。
前 言
银屑病是最常见的慢性炎症性皮肤病之一,它由明显的过度增殖和角质形成细胞的终末分化不足导致,已知不同细胞类型(例如T细胞和树突状细胞)与多种细胞因子之间的复杂相互作用会导致银屑病的发展。从分子观点来看,仍未完全了解引起角质形成细胞与渗透表皮的炎性细胞之间相互作用的机制。最近的发现表明,非编码RNA,例如小RNA(miRNA)和长非编码RNA(lncRNA)可以通过在角朊细胞和炎症细胞中影响蛋白的表达和功能参与银屑病的发病机制。
环状RNA(circRNA)通过将外显子的3'端连接至相同外显子或上游外显子的5'端的反式剪接事件形成,它们通常存在于细胞质中,是高度稳定的、进化保守并且通常在多种人类疾病中异常表达,但大多数circRNA的功能仍有待公开。先前的研究尚未在来自银屑病患者的皮肤样本中揭示circRNA表达的全基因组景观(circRNAome)。因此,本研究使用高通量RNA测序(RNA-seq)对circRNAome进行了分析,并研究了病变皮肤和非病变皮肤之间主要差异背后的可能机制。进一步研究了组织中单个细胞类型中的circRNA表达模式,并探讨了在circRNAome中观察到的剧烈变化是否对全基因组miRNA表达模式有影响。
材料方法
患者样本
共计19名受试银屑病患者接受组织活检,从每个受试者中采集配对的病变和正常皮肤组织样本,提取RNA用于测序。
生物信息学分析
使用Bowtie2和Tophat2将测序clean reads比对至人参考基因组(hg19),find_circ用于发现circRNA,DESeq2用于差异表达分析。使用nCounter Human v3 miRNA面板(NanoString Technologies)用于miRNA分析。
NanoString nCounter、RNA原位杂交(CISH)等试验及更详细材料和方法可以在在线补充材料中找到。
结 果
1、 皮肤活检中circRNA的鉴定和表征
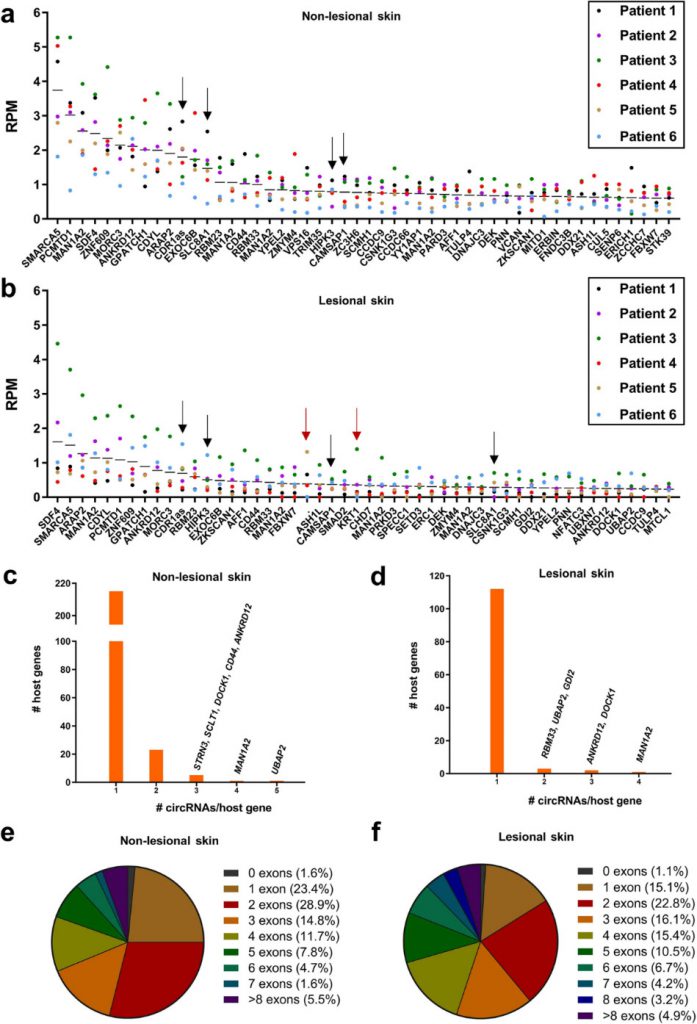
作者首先描述了在病变和正常皮肤组织中鉴定到的circRNA数量。使用find_circ工具(通过BSJ-reads支持)分析仅包括每种样品类型中平均至少5个BSJ-reads支持的circRNA,在病变和非病变皮肤中分别产生了128和285个circRNA(定义为高丰度circRNA)。为了减少误报,结合另一工具同时分析,大多数(>90%)的circRNA被CIRCexplorer工具(算法仅考虑从带注释的剪接位点衍生的circRNA)检测到。
因此识别的circRNA还是非常准确有效的,并继续描述了circRNA的表达水平、基因组来源、结构组成等。平均有41个(32.0%)和73个(25.6%)circRNA的表达水平高于其线性前体,并且检测到6个新型circRNA(circBase或CIRCpedia中不存在)。circRNA的表达在两种组织类型间存在组织特异性,由两个外显子组成的circRNA在两种样本类型中最常见。
图1,使用RNA-seq对病变和非病变皮肤中的circRNA进行表征。(a、b)在非病变皮肤(a)和病变皮肤(b)中,前50个最丰富的circRNA的表达水平;每个点代表独特的样本,circRNA表达以RPM显示,黑色箭头表示前10位的circRNA,红色箭头表示circBase中不存在的circRNA;(c、d)直方图显示了在非病变皮肤(c)和病变皮肤(d)中产生各种独特的高丰度circRNA的宿主基因的数量;(e、f)饼图显示了非病变皮肤(e)和病变皮肤(f)中高丰度circRNA中注释的外显子数量的分布。
2、 相对于正常皮肤,银屑病皮损皮肤中的circRNA含量较低
在简述鉴定到circRNA特征概况等后,作者比较了病变和正常皮肤组织间circRNA的整体表达水平。已知circRNA的表达存在组织特异性,对于在病变和非病变皮肤活检中共检测到298种独特的高丰度circRNA,更多位于正常皮肤中,同时发现病变皮肤中这些circRNA的表达普遍较低。通过差异表达分析寻找重要的circRNA,共计148个circRNA在病变皮肤中显著下调。
为了解释病变组织中circRNA存在普遍下调的可能原因,作者猜测可能归因于其宿主基因表达降低所致,通过比较与线性RNA的表达谱,发现很多circRNA独立于宿主基因表达而下调,尽管也有大量存在协同性。
接下来排除观察到的下调是否是由实验偏差引起。为了排除传统测序时逆转录(RT)过程可能导致“伪circRNA”,作者使用了一种无酶技术(称为NanoString nCounter)分析相同样本中整个数据集中最丰富的50个circRNA的表达,再次观察到circRNA在病变皮肤中普遍显著下调。扩展其它数据集验证普遍性,现象同样如此。最终证实:病变皮肤中circRNA的表达普遍较低。
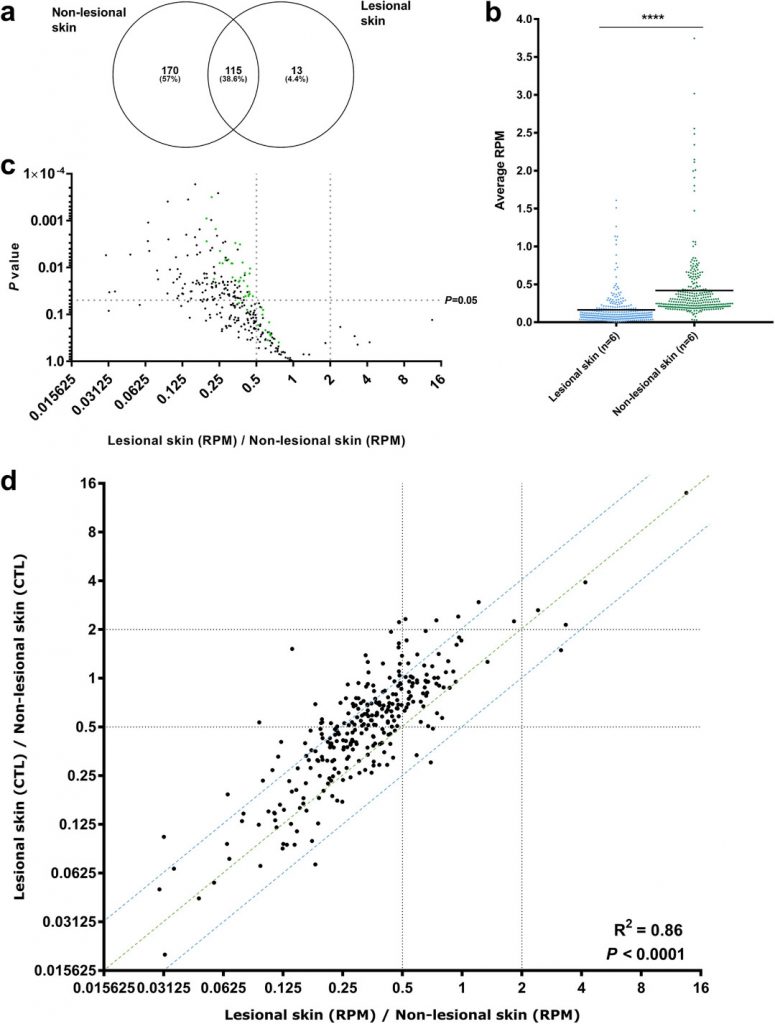
图2,相对于非病变皮肤,circRNA在病变皮肤中大量下调。
(a)Venn图,说明在病变和非病变皮肤中检测到的circRNA重叠;
(b)散点图显示,相对于正常皮肤,病变皮肤298个独特的高丰度circRNA的平均表达量较低;
(c) 298个独特的高丰度circRNA的火山图,根据重要程度显示了病变皮肤和非病变皮肤之间RPM中circRNA表达的倍数变化,前50个最丰富的circRNA用绿色表示;
(d)RPM倍数变化和高丰度circRNA的CTL倍数变化的散点图,可以观察到大多数circRNA均被下调,与它们各自的宿主基因无关(定义为存在于蓝线之间的基因)。
3、 已知的影响circRNA生物发生的因素不太可能是导致受损皮肤circRNA下调的主要驱动因素
上述观察到重要的现象,病变皮肤中circRNA的表达普遍较低。那么,什么原因导致呢?已知几种RNA结合蛋白能调节circRNA生物合成,作者推测这些基因的表达变化可能解释了病变皮肤中circRNA的下调。作者检索了一些重要的circRNA,它们由ADAR、FUS、DHX9、HNRNPL、QKI等编码,结合使用RNA-seq数据和NanoString nCounter数据时,ADAR在受损皮肤中均显著上调。考虑到ADAR可以抑制BSJs[两侧的IAEs之间的碱基配对介导的circRNA的生物发生,因此作者进而针对每个高丰度circRNA在BSJs(总距离)两侧的一定区域内寻找IAEs。发现有IAEs的circRNA不存在比无IAEs的circRNA下调更多的趋势,暗示其它机制可能是造成病变皮肤中circRNA下调的原因(即ADAR等RNA结合蛋白不太可能是成因)。
4、 circRNA在皮肤活检的不同细胞区室中的表达
上述线索中断,随后转到另一方向继续探讨。已知损伤性银屑病皮肤比非损伤性皮肤含有更多的炎症细胞,如淋巴细胞。如果淋巴细胞比角质形成细胞含有更少的circRNA,这可能是对受损皮肤circRNA下调的合理解释。即继续从炎症细胞的角度论述。通过组织活检,发现尤其是在受损皮肤真皮,淋巴细胞数量相对于正常皮肤更多。通过分析T细胞特异性基因的表达水平,六个T细胞特异性基因中的四个在病变皮肤中显著上调。证实了病变皮肤中炎症细胞更活跃。由于大多数淋巴细胞都位于真皮中,将真皮与表皮分离,并使用NanoString nCounter分析了circRNA的表达,发现尽管真皮中显著下调的circRNA数量明显少于表皮,但ADAR仍存在上调,因此可认为ADAR确实对circRNA下调无贡献。
此外,为了支持circRNA主要在表皮中下调的发现,对ciRS-7进行了RNA显色原位杂交(CISH),因为该circRNA在RNA-seq数据和NanoString nCounter数据中均显著下调。CISH验证了circRNA主要在表皮中下调的观察结论。
5、 皮肤活检中miRNA的鉴定和表征
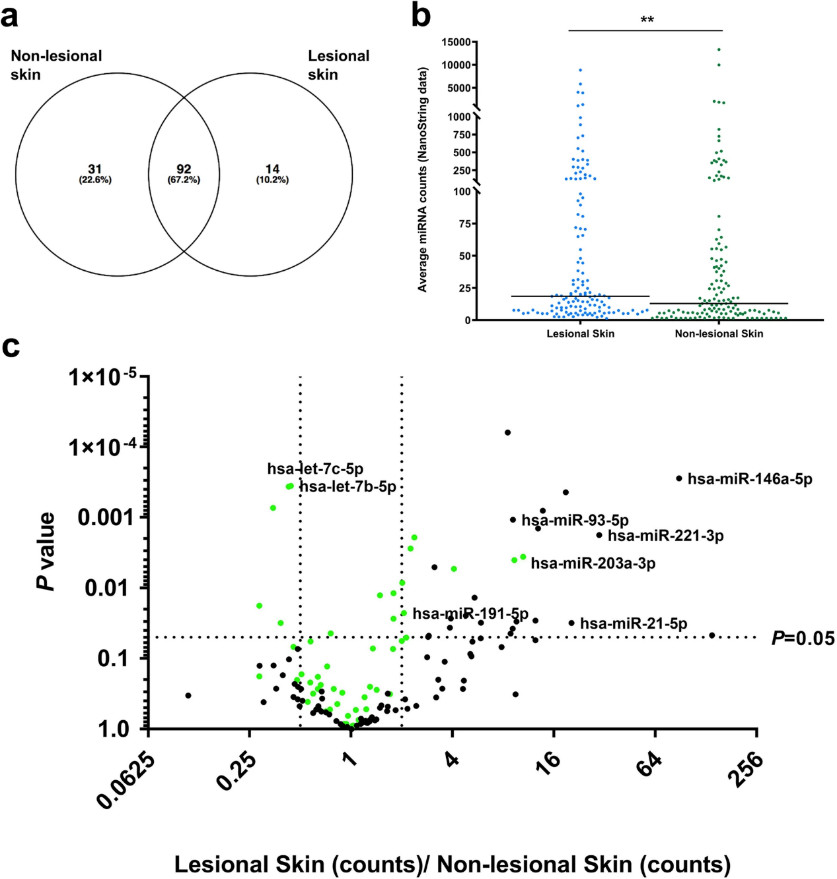
已经证实circRNA在损伤性皮肤中显著下调是普遍现象,作者进一步推测其可能产生的影响。总所周知circRNA发挥作用的形式一般是作为miRNA的海绵功能,先前已报道的与银屑病相关的miRNA表达存在改变,作者推测二者密不可分。为了研究这一问题,使用NanoString Technologies在病变和非病变皮肤中分析了约800个miRNA的表达。检测到137个独特的高丰度miRNA,共有37差异表达miRNA中31个在损伤皮肤中上调。可得结论,circRNA和miRNA的表达水平是相反的。
图6,使用NanoString nCounter分析表征皮损和非皮损皮肤中的miRNA。(a)Venn图,说明在病变和非病变皮肤中检测到的miRNA之间的重叠;(b)相对于正常皮肤,病变皮肤中137个高丰度miRNA的平均表达更高;(c)137个高丰度miRNA的火山图,前50个最丰富的miRNA以绿色表示,先前研究证实的在银屑病中差异表达的miRNA显示其名称。
6、 circRNA和miRNA之间潜在相互作用的研究
在证实了circRNA和miRNA存在关系后,作者分析了银屑病中miRNA与circRNA之间的潜在相互作用,只考虑了高丰度的circRNA和miRNA。通过预测了每个单独circRNA中的miRNA结合位点,circRNA的变化而导致miRNA差异表达的最佳候选者是miR-203a-3p,归因于其结合位点最多。但没有观察到circRNA中miRNA结合位点的丢失与病变皮肤和正常皮肤之间miRNA表达水平的差异之间的任何相关性,即没有反映出circRNA和miRNA在银屑病中的普遍相互作用。
讨 论
该项研究中,首次描述了来自银屑病患者的病变和正常皮肤中circRNA表达谱。数据表明,circRNA在病变皮肤中广泛下调。这种现象主要限于表皮,无法通过已知影响circRNA生物发生的因子的表达变化或样品中淋巴细胞数量的差异来解释。病变皮肤中circRNA的下调可能与circRNA的被动稀释有关,这是由于皮肤表皮中角质形成细胞的高增殖和周转率引起的。数据不支持circRNA通过改变miRNA表达水平而在银屑病发病中发挥积极作用。
综上,作者首先描述了circRNA全局表达谱,寻找了差异的circRNA,随后总结观察现象,以及对circRNA差异表达的成因和可能产生生物学功能的作了解释。
尽管本研究是一篇描述性的研究,但作者在思路上还是比较严谨的:
(1)在鉴定circRNA时,考虑了两种算法;
(2)除了常规的RNA-seq分析,为了排除实验偏差引起的错误结论,还使用了一种无酶技术(NanoString nCounter)结合论述,二者一致的结论更具说服力;
(3)对于在过程中排除的观点,作者也使用了多种方法解释它被排除基于了合理依据。




来第一个抢占沙发评论吧!