文章来源于小柯生命 ,作者小柯
2020年3月24日,中山大学张锐课题组在《自然—结构和分子生物学》(Nature Structural & Molecular Biology)杂志发表题为“irCLASH reveals RNA substrates recognized by human ADARs”的研究论文, 特聘副研究员宋玉龙博士及博士生杨文兵为该论文的并列第一作者。
该研究开发了一个高效的捕获特定RNA结合蛋白双链RNA底物的建库测序技术(irCLASH)以及后续的一整套生物信息学分析方法。
基于该方法,作者对人类RNA编辑核心蛋白ADAR的细胞内双链RNA底物进行检测,首次在转录组水平上系统地绘制了ADAR蛋白的内源双链RNA底物图谱。
通过对ADAR双链RNA底物进行系统的生物信息学分析及实验验证,作者揭示了决定ADAR结合效率和编辑效率的底物特征和ADAR结合长双链RNA的体内模型。
ADAR蛋白家族能结合到特定RNA的双链区域,并催化A碱基发生脱氨基反应生成I碱基,导致A-to-I RNA编辑。
A-to-I RNA编辑是动物中最普遍的RNA编辑类型,广泛的参与转录水平和转录后水平的多种基因调控机制,比如在转录组水平改变氨基酸序列,调控mRNA剪切、mRNA稳定性和环状RNA形成等等。
在哺乳动物细胞中,ADAR蛋白家族含有三个成员:ADAR1、ADAR2及ADAR3,它们在多器官发育、大脑功能中发挥重要的功能。
最近的研究表明ADAR1介导的非编码区域RNA编辑可用于标记“自我”和“非我”RNA,在先天免疫系统中起了重要的负调控作用。
但是具体哪些ADAR的RNA底物是最关键的可以调控免疫反应的天然底物还不知道。
抑制ADAR1的编辑活性可以极大的促进肿瘤免疫疗法的效果,因此ADAR1可以作为肿瘤免疫疗法的重要靶标。
此外,目前针对特定位点突变导致的疾病主要从基因组水平修复。
比如CRISPR/Cas9系统直接从基因组水平修复突变位点,但这一系统在DNA和RNA水平都有脱靶效应,并且Cas9蛋白本身会刺激细胞免疫反应,这些都限制了其临床应用。
相比于DNA编辑,定点RNA编辑具有可控和可逆性,不影响基因组稳定性,并且可以只导入RNA而非蛋白,不会诱导免疫反应,在临床上具有一系列优势。
目前已有多个研究利用特定的导向RNA招募ADAR蛋白进行定点RNA编辑,但是这一领域最大的问题之一是RNA编辑效率低。
揭示内源ADAR如何有效地识别和编辑底物可以用于指导和优化RNA靶向编辑系统。
尽管刻画ADAR蛋白的内源RNA底物具有重要的意义,但由于技术的局限性,目前研究人员对ADAR内源底物的特性及A-to-IRNA编辑的强度如何通过双链RNA的结构和碱基组成精细的调控所知甚少。
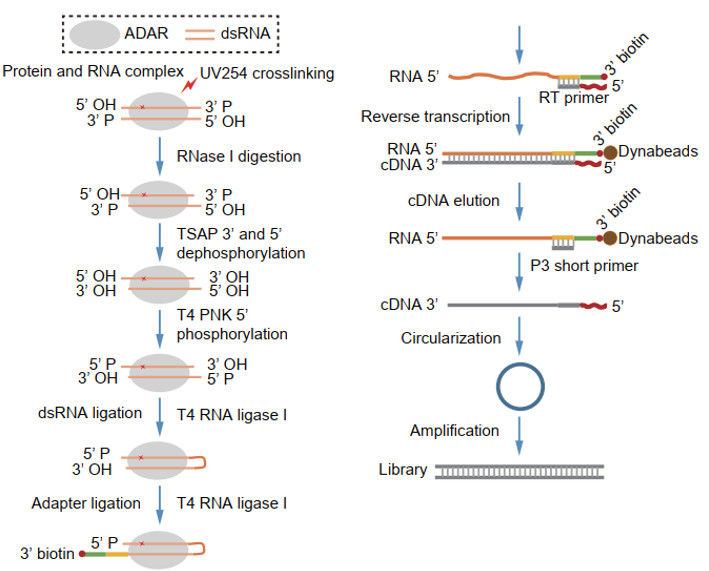
基于CLASH (crosslinking, ligation, andsequencing of hybrids) 的原理,作者通过TSAP酶和T4 PNK的组合使用以及新型接头的使用,提高了RNA分子间的连接效率和双链RNA底物的得率,使得研究人员可以在2天内完成整个irCLASH的建库流程(图1)。
同时,针对在建库过程中,双链RNA的两条序列的连接具有双向性的特点,作者开发了相应的分析流程,进一步提高了双链RNA底物的得率。
另外,作者利用ADAR的双链RNA和单链底物进行组装拼接,进而得到了完整的、全长双链RNA底物。
图1:irCLASH的建库流程。
与之前根据计算推导的研究设想不同,作者发现ADAR具有大量的、长距离的双链RNA底物。
作者还发现不完全互补配对的底物跟ADAR蛋白也有很好的亲和度,特别是ADAR2家族成员。
一般来说,一个底物双臂之间的距离越长,其底物的双链结合区域就越长,但是双臂的距离长度跟底物的配对程度没有太大的相关性。
通过对全转录组水平ADAR底物的一系列生物信息学分析及实验验证,作者进一步揭示了决定ADAR结合效率和编辑效率的底物特征。
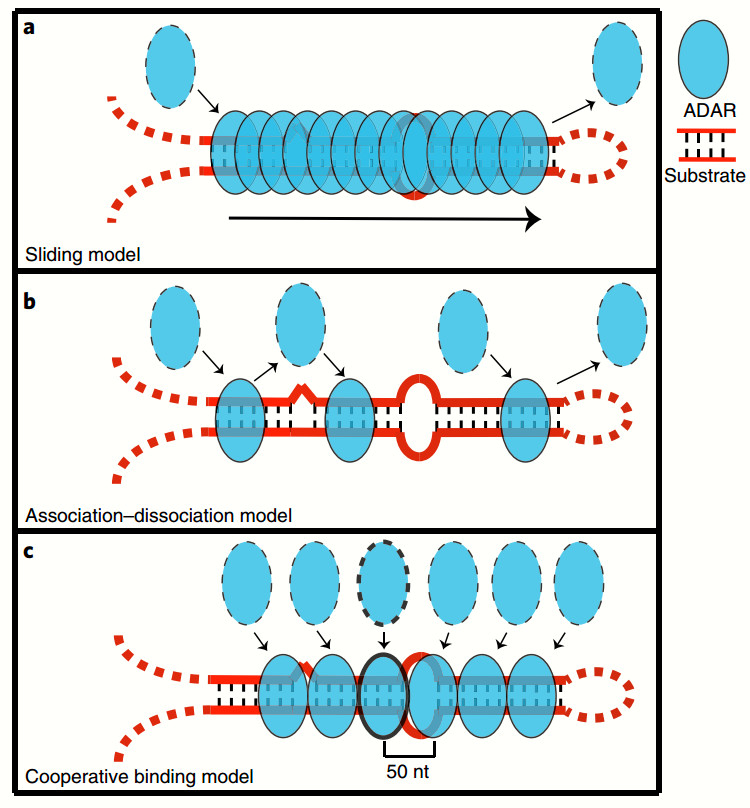
最后,作者意外地发现ADAR蛋白能够串联结合于双链RNA底物上,并且相邻两个蛋白分子间大约间隔50bp,通过这种串联结合可以提高其RNA底物的编辑效率。
基于上述发现,作者提出了一个ADAR结合长双链RNA的协同结合模型,这一模型为长双链RNA编辑效率较高这一现象提供了一个可能的分子水平的解释(图2)。
图2:ADAR结合和编辑长双链RNA底物的3种可能模型。其中模型C(协同结合模型),符合我们全转录组ADAR底物分析结果。
总而言之,作者通过开发irCLASH测序技术及后续的整套生物信息学分析方法为研究双链RNA结合蛋白的内源底物提供了新的工具。
利用这一工具,作者捕获和刻画了RNA编辑核心蛋白ADAR家族每个成员的内源双链RNA底物,揭示了决定RNA编辑位置和强度的特征,为研究ADAR的功能、调控机制等后续研究提供了基础。
同时,该研究揭示的ADAR与底物相互作用及催化特性为研究人员开发高效的RNA定点编辑工具提供了资源宝库及改进方向。
论文信息:DOI:10.1038/s41594-020-0398-4




来第一个抢占沙发评论吧!