心力衰竭是许多心血管疾病的最终常见病理。它是世界范围内死亡率和发病率的主要原因,这给人们带来了巨大的医疗压力,因此,迫切需要开发新颖的治疗方法。
作为基因表达的微调剂,miRNA在正常发育和体内平衡中起着至关重要的作用,其失调与多种疾病的发病机制有关。因此,靶向miRNAs是一种有希望的治疗途径。第一种抗miRNA治疗药物Miravirsen在II期临床试验中显示出抗丙型肝炎病毒感染的功效,且副作用极小。尽管对现有的miRNA干扰技术的不断开发和优化已在临床试验中带来了治疗益处,但仍然存在许多挑战——半衰期短、脱靶效应和不可代谢分子(例如LNA核苷酸)的潜在积累等。
环状RNA(circRNA)是一类新型非编码RNA,是细胞中普遍存在的环状单链RNA,研究表明,circRNA主要通过作为miRNA的海绵(sponge)来吸附并抑制miRNA,从而发挥调控作用。cicRNA没有5’端帽子和3’polyA尾巴,免受RNase介导的降解,因此能更稳定地存在于细胞中。
2020年4月14日,Molecular Therapy 上线了一篇来自新加坡国立大学的最新研究论文:Engineered circular RNA sponges act as miRNA inhibitors to attenuate pressure overload induced cardiac hypertrophy (工程化环状RNA通过海绵作用抑制miRNA来减轻压力超负荷引起的心肌肥大)。
该研究设计了一种靶向miRNA的circRNA海绵(circmiR),并通过体外和体内实验证实,能够有效抑制miRNA活性,并减轻心脏病小鼠模型的疾病进展。表明工程化circRNA具有非常大的潜力,可作为未来的治疗心脏疾病的方法。
病理性心肌肥大与心脏功能障碍和纤维化重塑有关,会损害心脏收缩和舒张功能,并最终发展为心力衰竭。
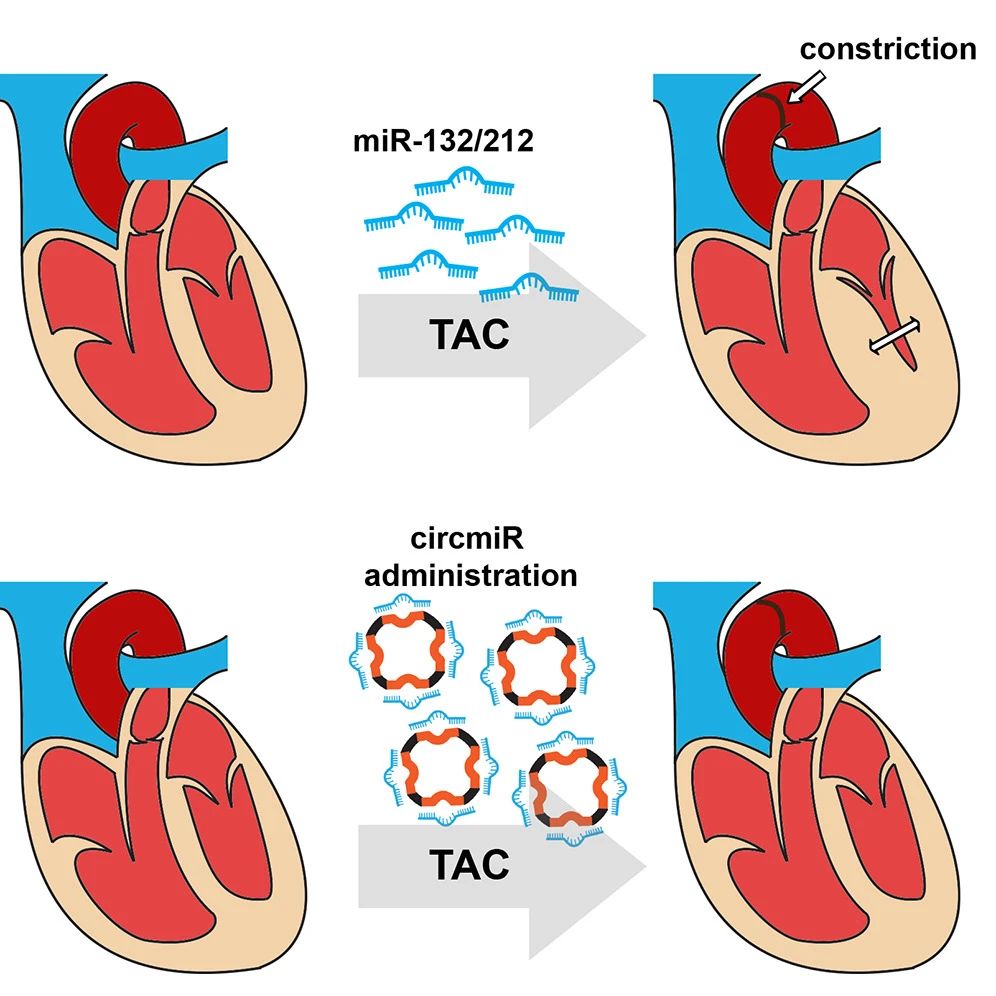
最近的研究表明,心肌细胞中miR-132/212家族的表达上调,会导致病理性心肌肥大,而通过miRNA拮抗剂抑制miR-132/212则会减轻心肌肥大进展,在动物模型中能够消除心力衰竭,目前已经开展1期临床试验。
在这项研究中,研究人员设计了靶向miR132/212家族的circmiR,以测试其对miRNA抑制的有效性,作为药物治疗的效果。
人为设计构建的circRNA海绵(circmiR)具有更低使用剂量和更长半衰期的优点。
研究人员构建了一个circRNA海绵(circmiR),以靶向已知的引起心肌肥大的miRs-132和-212。在荧光素酶挽救实验中,表达的circmiR竞争性抑制miR-132和-212活性,并且比线性mRNA海绵具有更高的稳定性。
研究团队进一步确认,包含12个结合位点且间距为12个核苷酸的circRNA海绵(circmiR)设计最佳。
在心脏疾病的横向主动脉缩窄(TAC)小鼠模型中,使用腺相关病毒(AAV)在体内将circmiRs传递至心肌细胞。实验结果显示,肥大性疾病的特征减弱,并且在治疗的小鼠中心脏功能得以保留,证明了circmiR作为新型治疗工具的潜力。
此外,circRNA海绵(circmiR)在抑制miRNA功能方面比目前的金标准antagomiR具有更高的体外抑制效果。
总的来说,该研究设计了一种靶向miRNA的circRNA海绵(circmiR),并通过体外和体内实验证实,能够有效抑制miRNA活性,并减轻心脏病小鼠模型的疾病进展。表明工程化circRNA具有非常大的潜力,可作为未来的治疗心脏疾病的方法。




来第一个抢占沙发评论吧!