编译:罗睺,编辑:十九、江舜尧。
导读
神经精神疾病代表一系列严重和复杂的精神疾病,其确切病因尚不清楚。已有大量文献证明,大脑早期发育的障碍是许多神经精神疾病的发病机理。当前,神经精神疾病的诊断很大程度上依赖于主观认知评估,因为没有广泛接受的生化或遗传生物标志物可用于诊断精神疾病。环状RNA(circRNA)是一类具有闭环结构的新型内源非编码RNA(ncRNA)。近年来,我们对circRNA的表达谱和生物学作用的理解有了巨大的进步。在大脑里,与线性对应物转录本相比,circRNA特别富集并且表达更为丰富。它们在神经元突触中非常活跃。这些功能使circRNA对于了解脑部健康,疾病和神经精神疾病具有独特的重要性。这篇综述着重于circRNA在早期大脑发育和其他与神经精神疾病有关的与大脑相关的过程中的作用。此外,本文讨论了血液或脑脊液circRNA在神经精神疾病早期诊断中用作新型生物标志物的潜力。此处回顾的发现可能为神经精神疾病的发作和发展的病理机制提供新的见解。
原名:Circular RNAs in early brain development and their influence and clinical significance in neuropsychiatric disorders
译名:早期大脑发育中的环状RNA及其在神经精神疾病中的影响和临床意义
期刊:NEURAL REGENERATION RESEARCH
通讯作者:周春华,朱晶晶
通讯作者单位:河北医科大学第一医院,温州市第七人民医院
介绍
神经精神疾病是人类致残的主要原因之一,导致相当大的社会和经济负担。不幸的是,在过去的几十年中,大多数神经精神疾病(包括双相情感障碍,精神分裂症,自闭症谱系障碍和强迫症)的患病率都有所上升,并且还在继续上升。神经精神疾病的具体病因仍然未知。但是,遗传因素和环境因素之间的相互作用被认为是导致大多数神经精神疾病发作的原因。与环境风险因素相比,遗传变异被认为是因果关系。目前,特定神经精神疾病的诊断主要取决于观察到的行为障碍,包括认知,感知和社交行为受损。尽管进行了广泛的研究,但尚无用于风险评估,早期发现或早期诊断的客观测试或血清生物标志物,这限制了对神经精神疾病患者的有效及时治疗。进行神经精神病学研究的研究人员还面临许多其他挑战,包括难以获得用于比较研究的活检样品,以及缺乏能够紧密模仿人类异常行为的合适动物模型。
环状RNA(circRNA)是一类新兴的内源性非编码RNA(ncRNA),其包含闭环结构并通过在转录后过程中发生的蛋白质编码mRNA的反向剪接事件进行生物合成。最近,已经进行了大量研究以评估circRNA的生物学功能。这些研究的结果表明,circRNA具有调控潜力,可作为其靶微RNA(miRNA)和RNA结合蛋白的“海绵”。circRNA在大脑中的表达要比其线性对应物(如miRNA)丰富,并且在神经突触中具有很高的活性。circRNA在大脑中的独特性质表明,它们可能在维持大脑健康和预防神经疾病(包括神经精神疾病)的发展中起重要作用。
这篇综述主要讨论了circRNA与早期大脑发育之间的关系。作者还讨论了使用血液或脑脊液(CSF)circRNA进行早期发现和诊断特定神经精神疾病以及描述潜在致病机制的潜力。
主要内容
circRNA的生物合成,功能和作用机理
circRNA代表一类新型的天然ncRNA,具有单链闭环结构,并且在基因表达的调节中起重要作用。大约四十年前,使用电子显微镜在细胞质中首次发现了它们。但是,人们认为circRNA是天然副产物,没有生物学目的。到1980年代初期,已证明circRNA源自转录后剪接,并可能与某些疾病的发病机理有关。最初,circRNA很少引起关注,因为没有技术方法来调查其功能。随着核糖体RNA(rRNA)缺失的RNA高通量测序的最新进展,结合生物信息学工具,对circRNA的生物学作用的研究在过去十年中已大大加速。
先前的研究者对人类成纤维细胞进行了高通量rRNA耗尽的RNA测序,发现了超过25,000个circRNA。与线性ncRNA(例如具有5'和3'末端的miRNA和长非编码RNA(lncRNA))不同,circRNA缺少5'和3'末端,是在蛋白质的转录后反向剪接(交替环化)过程中产生的。大部分circRNA源自一个或多个蛋白质编码基因的外显子。与人类成纤维细胞中的这些早期发现相一致,最近在胚胎脑中的一项研究表明,大部分circRNA与人类基因组的外显子对齐,而只有一小部分从内含子或基因间区域。随后的研究发现了通过外显子的直接反向剪接或外显子的选择性剪接形成circRNA的两种主要方法。对于外显子的反向剪接,重复序列的内含子配对(包括形成高度稳定碱基对的黄体节杆菌(Alu)元件)是驱动和增强环化的催化剂,也称为外显子的直接反向剪接。
通过去除几个连续的外显子开始通过外显子的可变剪接产生circRNA。在这些机制中,外显子的直接反向剪接被认为在circRNA的形成和闭合中占主导地位。为了理解circRNA生物合成的基础机制,在合成过程中,剪接体机制与剪接位点的环化有关,因为通常需要规范的剪接位点进行环化。此外,相关研究还发现特定的剪接抑制剂显着消除了circRNA的形成。但是,仍然不清楚剪接体如何发挥作用来合成circRNA,
最近,Kocks及其同事使用一种新开发的单分子RNA荧光原位杂交(smRNA FISH)方法进行双色成像,对P19神经元细胞系中circRNA CDR1as的亚细胞定位进行了定量和研究。他们证明CDR1as阳性颗粒在P19神经元的细胞体(soma)和突触过程(树突和轴突)中很明显。这些发现与先前的结果一致。有研究者使用高分辨率原位杂交技术检测了海马神经元中 circRNA的亚细胞定位和海马片。他们在细胞体和突触过程中都检测到了circRNA。然而,仍然未知如何在神经元中合成circRNA,然后将其转运至细胞体和突触过程。
circRNA的基因调控涉及多个步骤,并已针对一些已知的circRNA进行了证明:
(1)circRNA可能与其在细胞质中的靶标miRNA相互作用,以在转录后水平上调控基因表达。circRNA可以充当“海绵”,竞争性地吸收miRNA,从而解除miRNA对其靶mRNA的抑制作用并促进转录后基因表达。
(2)circRNA可以充当RNA结合蛋白的海绵,充当基因表达的转录后调节剂。Dudekula等使用生物信息学工具的组合分析了大规模的转录组数据,以建立强大的在线工具来预测circRNA上的RNA结合蛋白结合位点。
(3)circRNA可能在转录水平上对基因表达发挥调节作用。
在神经元中,circRNA Cdr1as被认为是某些miRNA的主要调节因子。大量研究表明,Cdr1as参与了其靶miRNA(例如miR-7,miR-671)的调节。circRNA Cdr1as如何与其目标线性ncRNA相互作用的机制及其完整功能需要进一步研究。最近,Piwecka及其同事发现,人和小鼠大脑中的Cdr1as含有miRNA-7和miR-671的多个结合位点。在随后的研究中,使用CRISPR / Cas9基因组编辑技术删除Cdr1as显着提高了miR-7水平,降低了miR-671水平,表明Cdr1as与这些miRNA之间存在直接相互作用。值得注意的是 Cdr1as及其靶线性ncRNA之间的相互作用与小鼠的正常脑功能有关,因为从基因组中去除Cdr1as基因座会导致感觉运动门控功能障碍,并且这种能力的缺陷与神经精神疾病有关。此外,其他miRNA在大脑中保持不变,这与之前的研究一致。
因此,circRNA可能在基因的转录,转录后和翻译调控中充当新的角色,而它们对人类健康和疾病的贡献有待进一步阐明。
circRNA的表达模式及其与大脑发育和神经系统过程的关系
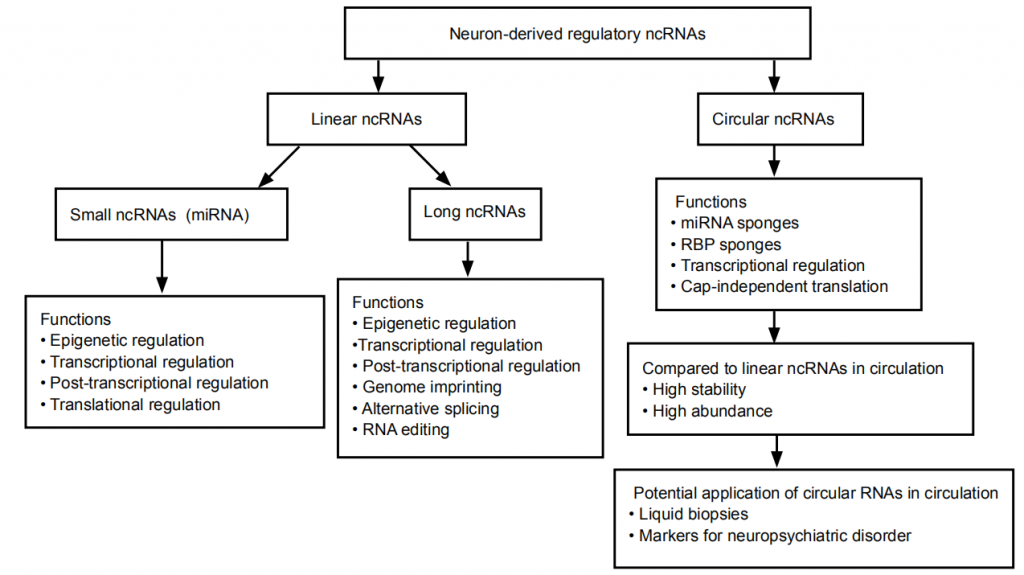
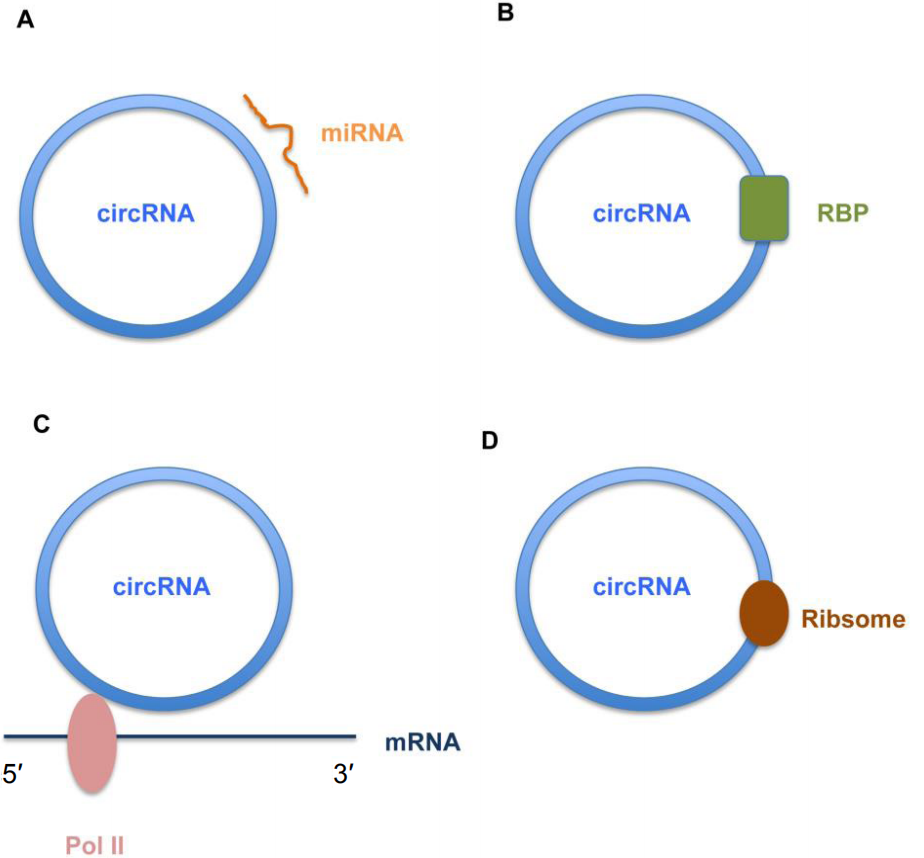
近年来,在发现circRNA在多种组织(包括大脑)中的表达模式和生物学作用方面取得了巨大进展。图1总结了神经元衍生的线性和环状ncRNA及其潜在功能。用海马切片切开的突触小体和神经纤维进行的研究与以下观点相一致:circRNA在大脑中比其线性对应转录本更丰富地表达。在对小鼠circRNA的丰度和组织特异性进行的比较分析中,与其他器官(如心脏,肝脏,肺脏和肝脏)相比,大脑中circRNA的相对丰度要高得多。最近,Chen等在人类胚胎脑发育的不同阶段对circRNA进行了表征,发现circRNA的丰度和表达谱在大脑的不同发育阶段发生了变化。他们分别检测到在早期和晚期表达的4324和4425circRNA,而在这两个阶段均表达了6550 circRNA。在这两个阶段表达的circRNA中,有104种在大脑发育的早期和晚期表达不同。此外,最近的其他研究表明,circRNA在小鼠,大鼠和人类的整个大脑发育过程中都是动态表达和时空调节的。值得注意的是,与其他研究组织(包括睾丸,肾脏,胸腺和肝脏)相比,在大脑中观察到数量最多的受发育调节的circRNA。尽管如何调节这些依赖于发育的circRNA的基本机制仍然难以捉摸,但这些发现表明,这些特定的circRNA在大脑发育的不同阶段可能发挥独特作用。提示circRNA主要通过海绵状miRNA调控宿主基因的表达。Mahmoudi和Cairns研究了circRNA与miRNA及其靶标mRNA的相互作用,发现在大鼠大脑发育过程中circRNA可能会使miRNA泛滥,从而导致其靶标mRNA的水平增加。circRNA的潜在调控作用或功能(图2)。
图1:神经元衍生的线性和环状非编码RNA(ncRNA)及其潜在功能和拟在神经精神疾病中的应用。
图2:环状RNA(circRNA)的调节作用或功能示意图。
(A)circRNA可能与靶标miRNA相互作用以调节基因表达;(B)circRNA可以充当RNA结合蛋白(RBP)的海绵,以调节基因表达;(C)circRNA可能通过RNA聚合酶II(Pol II)发挥潜在的调控作用;(D)circRNA可以翻译成蛋白质。
因此,circRNA具有以下特性:(1)与其他组织相比,circRNA在大脑中含量更高;(2)大脑中的circRNA在突触中特别富集;(3)circRNA具有发育阶段特异性;(4)circRNA与其线性对应物相比更稳定;(5)大多数circRNA是保守的,但含有内含子序列的circRNA在物种之间保守性较差;(6)circRNA可以包裹在外来体中,穿过血脑屏障进入循环系统。
在两项针对果蝇和小鼠的研究中,rRNA缺失的RNA深度测序表明circRNA的结构和序列性质与人类相似。在大脑突触体的高通量测序中,研究人员检查了突触中circRNA的表达谱。值得注意的是,大多数circRNA主要分布于突触,而最丰富的circRNA位于突触前的活性区。此外,它们源自编码与突触功能相关的蛋白质的基因。该研究还证明,大量circRNA在大脑发育的四个不同阶段E18,P1,P10和P30发生了改变。其中有43个在E18和P1处表现出峰值表达,但在随后的发育阶段表达下降。有趣的是,鉴定出181个circRNA在P10和P30达到峰值。在大脑发育的后期,一种circRNA Rmst的表达明显下降。此外,在小鼠的突触形成和成熟时,在发育的早期阶段,circKlhl2表达水平增加。这些发现支持了circRNA在神经元分化和大脑发育过程中调节突触相关功能的假设。
大脑是基因表达经过微调的最复杂的器官,可确保神经过程的正常运行,因此,circRNA异常的表达模式可能与神经精神疾病的发展有关。为了确定这些差异表达的circRNA是否与突触的可塑性有关,使用了细胞培养模型来诱导可塑性。有趣的是,在诱导可塑性后,circRNA分析揭示了37种上调的circRNA和5种下调的circRNA,表明这些circRNA与突触可塑性之间存在联系。尽管取得了重大进展,但研究者对circRNA及其与大脑发育的关系的了解仍然有限。
外泌体circRNAs在神经精神疾病研究中
很难获得用于研究神经精神疾病的人脑活检标本,因为人脑通常难以接近并且组织只能通过侵入性手术获得,而这在临床上是不实际的。这是脑疾病研究的主要瓶颈之一,特别是对于神经精神疾病。此外,很少有动物模型可以模仿特定人类神经精神疾病的临床表现。实际上,研究人员一直在寻找替代模型,以消除对人脑活检的需求。但是,我们缺乏非侵入性或微创方法来确定与神经精神疾病的发病机理相关的遗传变化。环状rna从脑细胞中脱落,进入血液和脑脊液;因此,液体活组织检查可以有助于了解某些起源于大脑的环状rna。
迄今为止,对血液或脑脊液中循环circRNA及其与神经精神疾病的关系的了解很少。然而,对循环中的ncrna,如mirna、lncrna和circrna的广泛研究已经在肿瘤学领域展开。这些研究为其他研究领域铺平了道路,包括神经精神疾病。例如,外泌体中的环状miRNA,即直径在40-100纳米范围内的胞外小泡,被称为外泌体环状RNA,因为它们维持了其起源的实体组织的特性,因此在癌症中得到了广泛的研究。此外,外泌体miRNA的丰度和模式在癌症患者和健康参与者之间存在显著差异,环状miRNA已经被认为是潜在的癌症诊断的液体活检生物标志物。这些发现对于研究大脑发育及其与精神疾病的关系特别重要,因为目前还没有大脑活组织切片检查,而且研究人类也存在其他限制。使用人类血液和脑脊液来评估circRNA模式及其与精神疾病的关系可能提供有价值的信息。因此,对血液或脑脊液中的外泌体环状RNA的研究代表了一种新的方法来破译神经精神疾病的发病、发展和进展背后的分子机制。
处理细胞外囊泡(包括外泌体)时存在技术挑战。使用常规的高通量RNA测序很难从血液或CSF中分离出足够的外泌体来分析外泌体circRNA。可以通过超低输入RNA测序和外泌体制备新方法的开发来克服这一局限性。我等。(2014年,2015年)开发了一种基于表面等离振子共振的外泌体分离新技术,其中一种名为纳米等离激体外泌体传感器的芯片可以以最佳精度特异性捕获外泌体。值得注意的是,纳米等离子体外泌体芯片仅需要少量样品,并且系统显示出高灵敏度和特异性,这对于从小体积CSF样品制备外泌体是有益的。
在处理细胞外囊泡(包括外泌体)时存在技术挑战。从血液或脑脊液中分离出足够的外泌体是困难的,因为使用传统的高通量RNA测序分析外泌体环状RNA是很困难的。这种限制可以通过超低输入RNA测序和开发新的外泌体制备方法来克服。Im等人开发了一种基于表面等离子体共振的外泌体分离新技术,其中一种被称为纳米等离子体外泌体传感器的芯片允许以最佳的精度特异性捕获外泌体。值得注意的是,纳米等离子体外泌体芯片只需要少量的样品,且系统具有较高的敏感性和特异性,这有利于从低体积CSF样品制备外泌体。
外泌体circRNAs作为神经精神疾病早期检测和诊断的潜在生物标志物的观点。
为神经精神疾病的早期检测开发新型的非侵入性血清生物标记物是临床神经精神科医生的首要任务。有趣的是,与细胞质和全脑裂解物相比,circRNA在突触神经小体中特别丰富且高度活跃。鉴于突触功能障碍与早期大脑发育异常和许多神经精神疾病的突触可塑性密切相关,这些发现表明与突触神经小体相关的循环circRNA的异常表达可能为早期发现和诊断神经精神疾病提供潜在的生物标志物。最近,徐等研究人员发现大多数哺乳动物细胞释放的外泌体或细胞外囊泡中大量稳定地存在circRNA。这些也称为外泌体circRNA,此外,通过深度RNA测序表征了从健康个体获得的人血样品中外泌体circRNA的概况,并鉴定了外泌体中长度<1000 nt的1215个circRNA。其中,大多数(> 90%)是由蛋白质编码外显子产生的,一小部分来自人类基因组的内含子或其他区域,这与circRNA的特征来源相符。像其他形式的ncRNA一样,通过定量逆转录聚合酶链反应分析可以检测和定量血液中外体circRNA的水平。
内体膜的内向芽形成外泌体,最近的研究表明神经元可以分泌含有各种ncRNA的外泌体,例如miRNA和lncRNA。平均直径小于100 nm的外泌体可以穿过血脑屏障进入血液和CSF,这表明circRNA可以主动移出大脑。这支持了外泌体circRNAs可能是早期发现神经精神疾病的优秀生物标记的观点。还已在CSF样品中鉴定了外泌体miRNA,并提出了对CSF中循环miRNA的分析以诊断原发性中枢神经系统淋巴瘤的方法。
因此,由于以下四个特性,外泌体circRNAs可能是诊断人类神经精神疾病的一种更好的生物标记物类型:(1)外泌体circRNAs高度稳定,主要是因为它们的结构特征不具有3'和5'末端以及它们的位于外泌体内部的位置,可保护其免受RNAase降解;(2)从脑细胞中排出外泌体circRNA,进入血液和脑脊液,同时保持circRNA的大脑表达模式(原始特征);(3)通过逆转录-聚合酶链反应可以检测到来自血液和脑脊液的外泌体中的外泌体circRNA;(4)与精神疾病的可变表型特异相关的外泌体环状rna可以克服目前用于诊断神经精神疾病的传统诊断模式的局限性。
结论
circRNA在人脑中是发育阶段特异性的,在神经元的突触中特别丰富且高度活跃。与早期大脑发育相关的circRNA对于理解神经精神疾病的病理机制很重要。此外,血液和CSF中与神经精神疾病相关的circRNA有望作为潜在的非侵入性生物标记物,用于早期发现和诊断复杂的神经精神疾病。




来第一个抢占沙发评论吧!