黑色素瘤是来源于黑色素细胞的高度恶性肿瘤,易发生局部和远处转移。据统计,全球每年约有200000新发病例,导致约55000名患者死亡,是最为致命的一种皮肤肿瘤。
近年来,免疫检查点抑制剂为肿瘤患者带来福音,其疗效在黑色素瘤中尤为显著,然而免疫治疗不应答及耐药等问题亟待解决。因此,进一步探索黑色素瘤发生发展及免疫耐受机制成为当前研究热点。
环状RNA(circRNA)是一类闭合的环状单链非编码RNA,具有抵抗RNA 酶的降解作用而相对稳定。研究表明circRNA表达呈组织与细胞特异性。
作为新发现的非编码RNA,现有证据表明其具有广泛的生物学功能,其异常表达参与多种病理过程,特别是在肿瘤的发生发展中。到目前为止,在黑色素瘤中环状RNA研究较少。
近日,复旦大学附属中山医院整形外科的顾建英教授、亓发芝教授团队在 Molecular Cancer杂志 (IF:10.679)发表题为:Circular RNA circ_0020710 drives tumor progression and immune evasion by regulating the miR-370-3p/CXCL12 axis in melanoma 的研究论文。
研究发现一种新型环状RNA-circ_0020710在黑色素瘤中的生物学功能及潜在的分子机制:circ_0020710通过ceRNA调控机制促进CXCL12分泌,从而促进肿瘤细胞增殖侵袭,同时诱导肿瘤微环境免疫抑制。
该研究成果有助于加深对黑色素瘤发生发展机理的认识。同时,该非编码RNA有望指导临床,用于黑色素瘤的诊断及预后监测,并为PD-1单抗联合治疗提供了新的科学依据。
http://sci-hub.tw/10.1186/s12943-020-01191-9
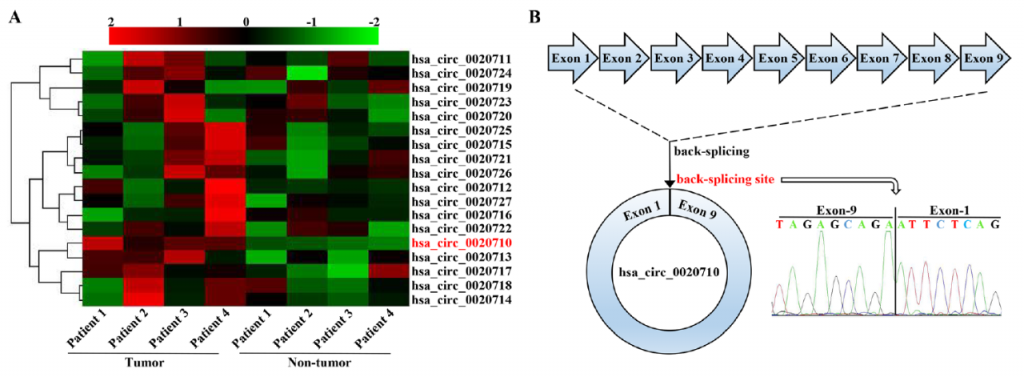
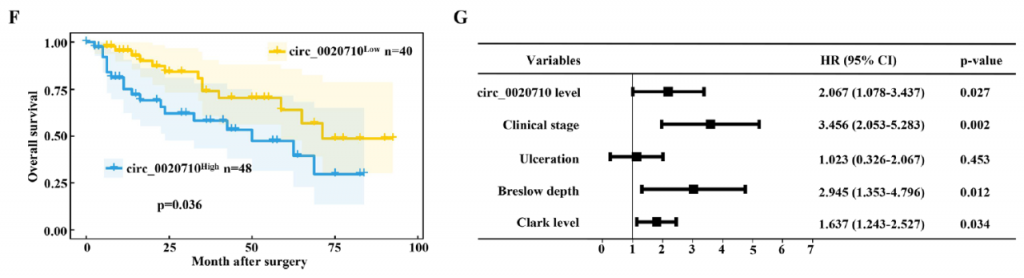
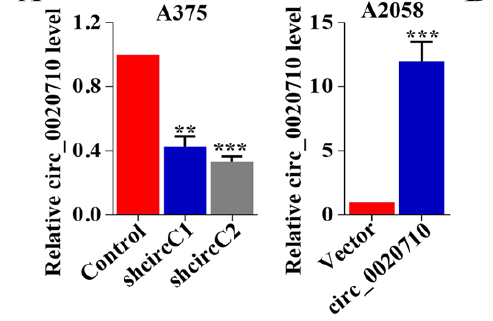
在这项研究中,研究人员首先通过Sanger测序及qRT-PCR等实验手段发现新型环状RNA circ_0020710在黑色素瘤组织中显著高表达,且高表达的circ_0020710与患者预后密切相关,可以作为检测患者预后的独立危险因素。
图1. circ_0020710在黑色素瘤中高表达且与患者预后相关
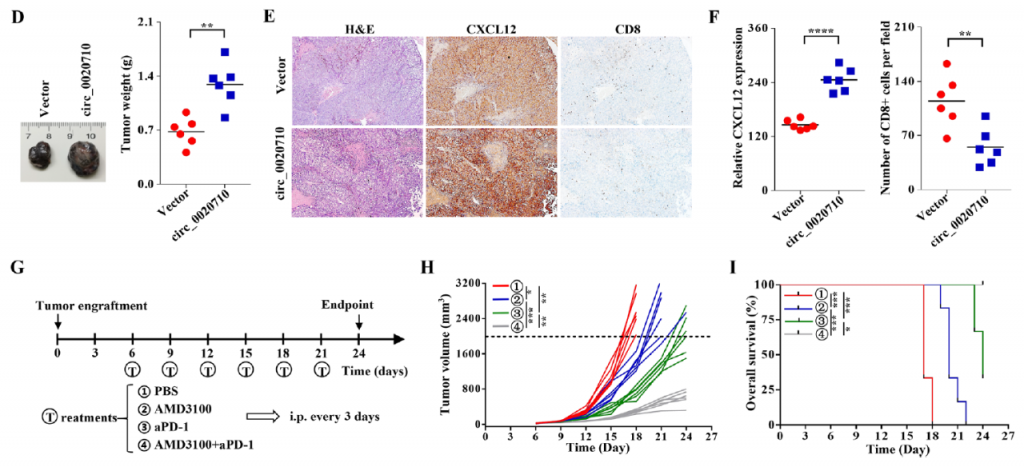
在此基础上,研究人员通过RNA-seq、双荧光素酶报告实验、免疫荧光结合共聚焦扫描等实验技术证实circ_0020710通过内源性竞争机制上调趋化因子CXCL12,从而招募抑制性免疫细胞诱导肿瘤微环境免疫抑制。
重要的是,靶向敲除该circRNA联合PD-1抑制剂可以显著抑制小鼠体内黑色素瘤的生长,并改善肿瘤局部的免疫抑制微环境。
图2. 靶向敲除circ_0020710联合PD-1抑制剂显著抑制肿瘤生长。
总的来说,该研究发现了黑色素瘤中新型非编码RNA circ_0020710通过ceRNA调控机制促进CXCL12分泌,从而促进肿瘤细胞增殖侵袭,同时诱导肿瘤微环境免疫抑制。
图3. circ_0020710促黑色素瘤发生发展及免疫逃逸的模式图。
该研究成果有助于加深我们对黑色素瘤发生发展机理的认识。同时,该非编码RNA有望指导临床,用于黑色素瘤的诊断及预后监测,并为PD-1单抗联合治疗提供了新的科学依据。
值得一提的是,该研究中使用的siRNA及shRNA由吉满生物科技(Genomeditech)提供,有效敲低了目的基因的表达。





来第一个抢占沙发评论吧!