青枫|circRNA微信公众号
骨关节炎(OA)是最常见的关节炎类型,软骨的破坏是OA的最主要标志。细胞外基质占软骨干重的90%,基质的生理变化直接影响软骨正常的生物学功能。软骨细胞是软骨中唯一的细胞类型,对于基质稳态的维持起着重要的作用。因此,描述参与OA发展和发病机制的软骨细胞的分子机制对于改善预后和开发有效疗法至关重要。
RIC8A作为G蛋白α亚单位的鸟嘌呤核苷酸交换因子,是秀丽隐杆线虫早期胚胎发生期间G蛋白信号传导和中心体运动的一种必需蛋白质,哺乳动物神经祖细胞中的RIC8A被破坏会导致基质出血的发生。RIC8A异常表达可能是人类OA发病机制中的一个关键因素,但是RIC8A在OA中的作用尚不清楚。翻译后修饰与疾病发展相关,可能影响蛋白质功能、免疫原性和亚细胞定位。泛素化是一种主要的翻译后修饰,在信号转导、凋亡和细胞增殖中起着重要作用。
目前,越来越多的研究发现了功能性的circRNAs,这些circRNAs具有组织特异性具有稳定的环状结构。越来越多的研究发现了其与疾病相关的生物学功能。作者团队先前的研究发现,circRNA可通过海绵化作用miRNA进而调控OA的发生和发展[1]。但是还不清楚是否有其它的分子机制也与circRNAs在OA中的分子机制相关。
本月浙江大学医学部邵逸夫骨科医院方向前和范顺武教授的团队在Ann Rheum Dis(IF 19.102)发表文章circPDE4B prevents articular cartilage degeneration and promotes repair by acting as a scaffold for RIC8A and MID1。研究了circPDE4B在OA中的功能和分子机制,为将来研究circRNA作为OA有希望的治疗靶点铺平了道路。

通过临床样本测序分析,circPDE4B在50个显著失调的circRNAs中表达水平排名第一,并通过验证发现其在OA患者软骨细胞中表达显著下调。考虑到circPDE4B在人和小鼠之间是保守的,如图1所示,作者在OA小鼠软骨细胞中也验证了circPde4b的表达情况。

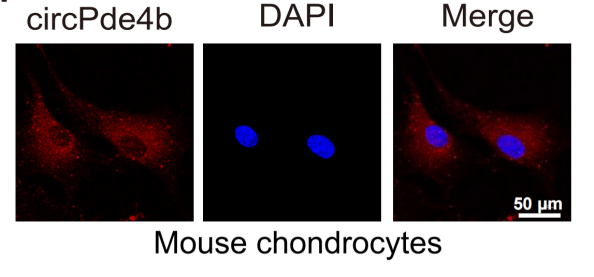
图 1
通过细胞实验研究circPDE4B在体外培养的人和小鼠软骨细胞中的作用。具体而言,进行RNA pull-down(RPD)-质谱分析(MS)、免疫沉淀、谷胱甘肽-S-转移酶(GST)下拉、RIP实验和RPD分析,以验证circPDE4B与RIC8A/MID1复合物之间的相互作用。进一步采用小鼠OA模型来确认circPDE4B在体内OA发病机制中的调控作用。
circPDE4B调节软骨细胞活力和细胞外基质代谢。在机制上,发现FUS RNA结合蛋白(FUS)促进circPDE4B的剪接,而OA中circPDE4B的下调部分是由上游FUS抑制引起的。如图2所示,作者通过实验验证发现circPDE4B作为RIC8A和MID1的支架调控蛋白酶体途径,RIC8A在K415的泛素化促进RIC8A的降解。以往的研究表明p38信号通路的激活与OA软骨损伤密切相关[2]。此外,MAPK作为关键的信号分子,参与基质金属蛋白酶的产生并调节软骨细胞的活力和分化[3]。考虑到作者使用western bloting实验验证发现circPDE4B通过RIC8A–p38轴发挥作用,该通路的破坏可能导致软骨内稳态失调。因此,circPDE4B–RIC8A轴在调节下游p38丝裂原活化蛋白激酶(MAPK)信号中起重要作用。此外,携带circPDE4B腺相关病毒(AAV)可消除小鼠内侧半月板失稳引起的软骨基质破坏,而RIC8A AAV则诱导相反的效果。
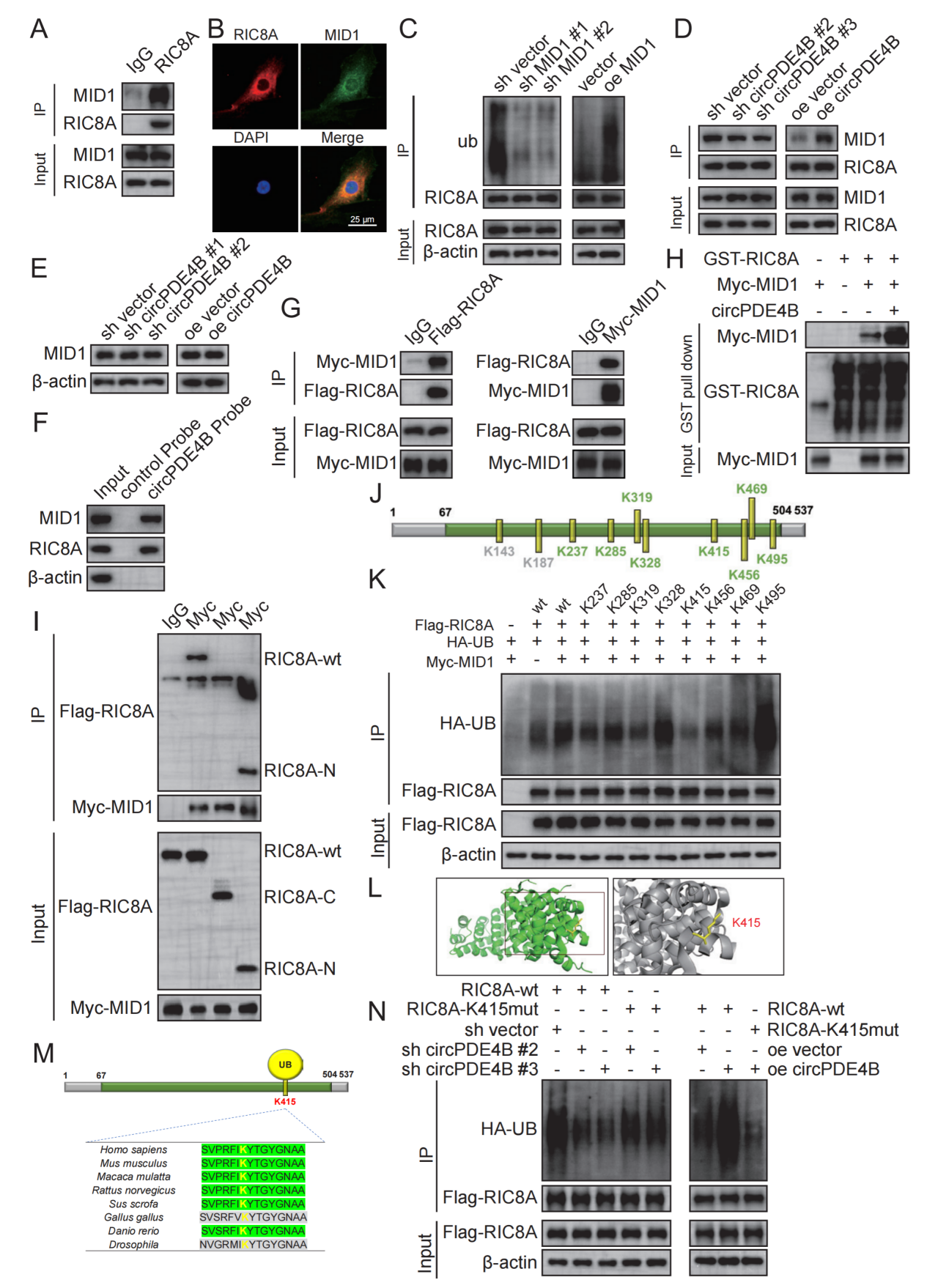
图 2
总之,如图3所示作者的研究描述了OA中一种新的circRNA机制。circPDE4B可以作为蛋白质降解的支架,在OA的进展中发挥关键作用。circPDE4B被发现调节ECM代谢和阻止软骨基质构建,在临床前动物模型中验证了其对OA发展的潜在治疗影响。在机制上,circPDE4B作为支架促进RIC8A–MID1结合,从而减少依赖RIC8A的p38信号通路激活,进而调节OA进展。综上所述,本研究的结果通过减少基质合成和降解之间的不平衡,为开发新型OA疗法提供了前景。
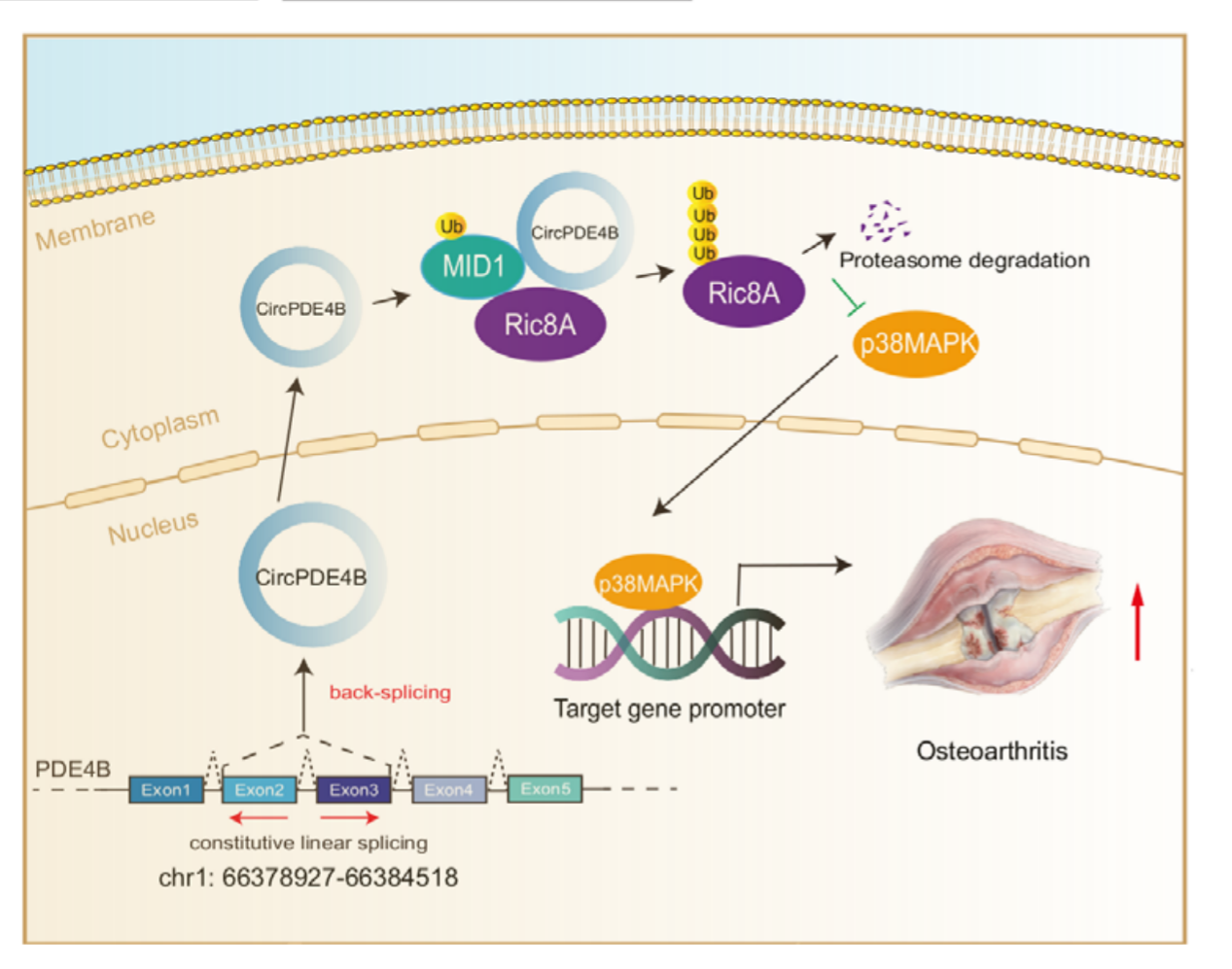
图 3
原文链接: https://pubmed.ncbi.nlm.nih.gov/34039624/
参考文献:
[1]. Shen S, Wu Y , Chen J, et al. CircSERPINE2 protects against osteoarthritis by targeting miR-1271 and ETS- related gene. Ann Rheum Dis 2019;78:826–36.
[2]. Prasadam I, Mao X, Wang Y , et al. Inhibition of p38 pathway leads to OA- like changes in a rat animal model. Rheumatology 2012;51:813–23.
[3]. Lee SA, Moon S- M, Han SH, et al. Chondroprotective effects of aqueous extract of Anthriscus sylvestris leaves on osteoarthritis in vitro and in vivo through MAPKs and NF-κB signaling inhibition. Biomed Pharmacother 2018;103:1202–11.




来第一个抢占沙发评论吧!