环状RNA(circRNA)是一类闭合环状的非编码RNA分子,起初被认定为是转录副产物,但随着测序和实验技术的不断发展,人们发现了很多具有功能的circRNA。它通过影响转录或转录水平的基因表达,可以作为miRNA内源性吸附体,基因转录和表达调节剂,RBP吸附体和蛋白质/肽翻译模板。功能较明确的既可以作为某些疾病诊断的生物标志物,也可以作为某些重要疾病,尤其是免疫性疾病和癌症的治疗性靶点,广泛应用于感染性疾病、罕见病、血液病、肿瘤的治疗,兼具研究和应用价值。
因其这些方面的作用,近几年备受青睐,这里整理了几篇相关的文章,希望能给大家提供一些新的研究思路。
1、Engineering circular RNA for enhanced protein production. Nat Biotechnol(IF:46.9)
环状RNA(circRNAs)是真核细胞中稳定且普遍存在的RNA,其通过反向剪接产生。合成的circRNAs和一些内源性circRNAs能够编码蛋白质,这使得circRNA成为基因表达的一个潜在平台。在本研究中,作者开发了一种系统的方法,用于快速组装和测试影响合成circRNAs蛋白质产量的特征。为了最大化circRNA的翻译,作者优化了五个元素:载体拓扑结构、5'和3'非翻译区域、内源核糖体进入位点和合成的特异性顺式启动子,以招募翻译起始机制。这些设计原则共同将circRNA蛋白质收率提高了数百倍,在体外提供了比信使RNA更高的翻译水平,在体内提供了更持久的翻译,并且适用于多个转基因。
原文链接:https://www.nature.com/articles/s41587-022-01393-0
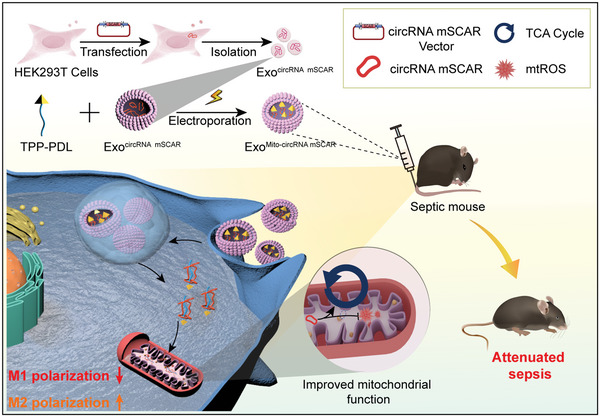
2、Exosome-Based Mitochondrial Delivery of circRNA mSCAR Alleviates Sepsis by Orchestrating Macrophage Activation. Adv Sci (Weinh)(IF:15.1)
脓毒症是一种常见的致死原因,与不受控制的全身性炎症密切相关。M1巨噬细胞极化失调是严重炎症的主要原因。本研究揭示了小鼠环状RNA SCAR(脂肪肝相关环状RNA ATP5B调节因子)的同源物,即后文称为环状RNA mSCAR,降低在脓毒症小鼠的巨噬细胞中,与过度的M1极化相关。为了将环状RNA mSCAR恢复到线粒体中,进一步使用聚-D-赖氨酸-三苯基膦接枝物(TPP-PDL)电穿孔封装了环状RNA mSCAR的外泌体,当外泌体被受体细胞吞噬时,TPP-PDL促进了结合的环状RNA进入线粒体。在体内脓毒症小鼠模型和体外细胞模型中,显示出基于外泌体的线粒体传递系统优先将环状RNA mSCAR传送到巨噬细胞中的线粒体,促使巨噬细胞向M2亚型极化。因此,基于外泌体的线粒体传递环状RNA mSCAR能够减轻系统性炎症,并减少死亡率。综上所述,结果揭示了环状RNA mSCAR在脓毒症中的关键作用,并提供了基于外泌体的线粒体传递环状RNA mSCAR来减轻脓毒症的有希望的方法。
原文链接:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10190648/
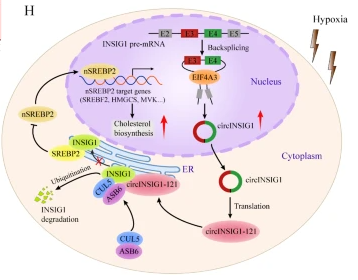
3、A novel protein encoded by circINSIG1 reprograms cholesterol metabolism by promoting the ubiquitin-dependent degradation of INSIG1 in colorectal cancer . Mol Cancer(IF:37.3)
缺氧是固体肿瘤的一个特征,会导致癌细胞的代谢重编程。缺氧与结直肠癌(CRC)中异常胆固醇代谢之间的表观遗传调控作用目前尚不清楚。一种名为circINSIG1的新型缺氧响应环状RNA被鉴定出来,在CRC组织中上调,并与晚期临床分期和差劣生存相关。机制上,circINSIG1编码了一个121氨基酸的蛋白质circINSIG1-121,通过招募CUL5-ASB6复合体(一个泛素E3连接酶复合体),在赖氨酸156和158位点促进关键的胆固醇代谢调节因子INSIG1进行K48链式泛素化,从而诱导胆固醇生物合成,促进CRC增殖和转移。正交异种移植瘤模型和患者来源异种移植瘤模型进一步确定了circINSIG1在CRC进展中的作用,以及其作为CRC潜在治疗靶点的作用。circINSIG1呈现了一种表观遗传机制,这提供了缺氧与胆固醇代谢之间相互作用的新见解,并为CRC的治疗提供了一个有希望的治疗靶点。
原文链接:https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-023-01773-3
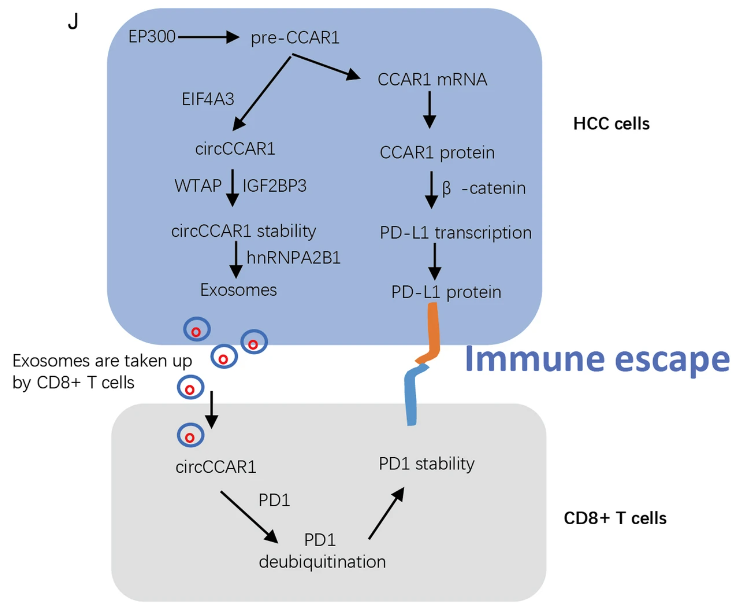
4、Exosome-derived circCCAR1 promotes CD8 + T-cell dysfunction and anti-PD1 resistance in hepatocellular carcinoma. Mol Cancer(IF:37.3)
环状RNA(circRNAs)可以封装进外泌体中,参与细胞间通讯,影响多种肿瘤的恶性进展。CD8+ T细胞功能紊乱是肝细胞癌(HCC)免疫逃逸的主要因素。然而,外泌体源circRNAs对CD8+ T细胞功能紊乱的影响需要进一步探索。在HCC患者的肿瘤组织、外泌体和血浆中,以及培养上清液和HCC细胞中存在较高水平的circCCAR1。circCCAR1 在体内外加速了HCC的生长和转移。E1A结合蛋白p300(EP300)和真核翻译起始因子4A3(EIF4A3)促进了circCCAR1的生物合成,WTAP介导的m6A修饰通过与IGF2BP3增强circCCAR1稳定性。circCCAR1作为miR-127-5p的海绵,上调其靶点WTAP,形成一个包含circCCAR1/miR-127-5p/WTAP轴的反馈回路。circCCAR1通过hnRNPA2B1依赖性的方式由HCC细胞分泌。CD8+ T细胞摄取外泌体源circCCAR1,并通过稳定PD-1蛋白导致CD8+ T细胞功能紊乱。circCCAR1促进了对抗PD1免疫疗法的耐药性。此外,EP300诱导的细胞分裂周期和凋亡调节蛋白CCAR1增加,促进了CCAR1与β-连环蛋白的结合,进一步增强了PD-L1的转录。circCCAR1/miR-127-5p/WTAP反馈回路增强了HCC的生长和转移。HCC细胞释放的外泌体源circCCAR1通过促进CD8+ T细胞功能紊乱而贡献于免疫抑制。circCCAR1导致对抗PD1免疫疗法的耐药性,为HCC患者提供了潜在的治疗策略。
原文链接:https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-023-01759-1
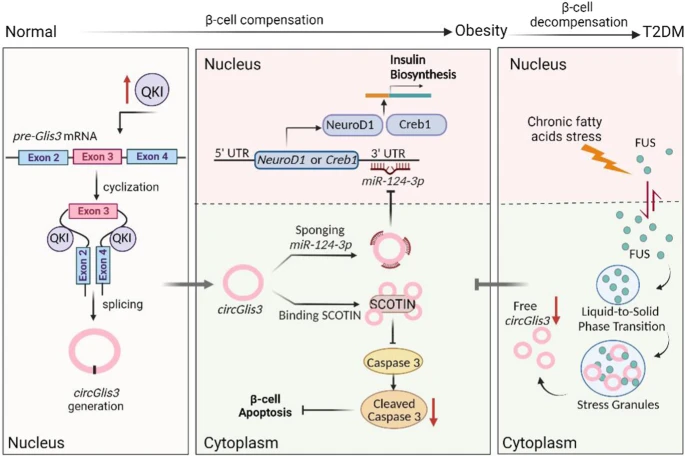
5、Circular RNA circGlis3 protects against islet β-cell dysfunction and apoptosis in obesity. Nat Commun(IF:16.6)
胰岛素β细胞补偿是延缓2型糖尿病进展的主要机制。本研究报告了肥胖雄性小鼠的胰岛及肥胖人群的血清中circGlis3的异常高表达。circGlis3的增加受Quaking (QKI)介导的剪接环化调节。circGlis3的过表达增强了体外和体内胰岛素分泌,并抑制了肥胖诱导的细胞凋亡。从机制上讲,circGlis3通过海绵吸附miR-124-3p上调NeuroD1和Creb1促进胰岛素分泌,同时通过与促凋亡因子SCOTIN相互作用减少细胞凋亡。RNA结合蛋白FUS招募circGlis3,并集体组装异常稳定的细胞质应激颗粒(SG)以应对细胞压力。这些发现突显了circRNA在β细胞补偿中的生理作用,并表明调节circGlis3的表达可能是预防肥胖后β细胞功能障碍和细胞凋亡的潜在策略。
原文链接:https://www.nature.com/articles/s41467-023-35998-z




来第一个抢占沙发评论吧!