环状RNA简介
大多数的线性信使RNA(mRNA)在转录后都需要经过复杂的加工程序,如在5’端加m7G帽子和在3’端加Poly A的尾巴等。但是近年来,大量以环状构象存在的RNA被广泛研究,其为共价闭合的单链非编码RNA,没有帽子和尾巴的结构,由 mRNA前体通过反向剪接产生。因其闭合的结构避免了被外切核酸酶降解,大多数可以保持稳定的状态,半衰期为18.8-23.7h,而与它同源的线性RNA的半衰期为4.0-7.4h。
早在1976年,闭合环状结构的基因组就被发现,但是因为其数量少且表达量低,所以环状RNA一直被认为是剪接中产生的副产物,不具备生物学功能。随着高通量测序技术的发展,这种不带Poly A尾巴的神秘结构也被慢慢地探索发现。它们通过不同的分子机制参与细胞各个层面的基因表达调控,在生理及不同病理条件下都具有重要的作用。如通过转录或转录后的方式调节基因表达;影响亲本基因的选择性剪接;形成环形RNA蛋白质复合体调控信号通路;作为miRNA的分子海绵调控下游靶基因的表达水平;在某些条件下可以被翻译成多肽或蛋白质等等的作用。
应用
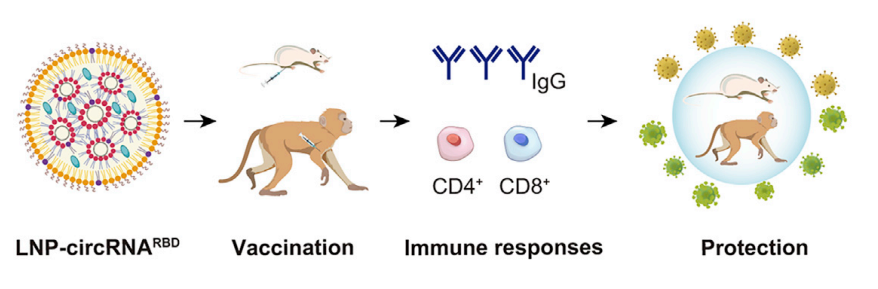
环状 RNA 在构象、稳定性和免疫原性方面不同于线性 RNA,这一特殊性使许多人尝试开发基于环状RNA的技术。包括使用环状 RNA 作为非编码适配体来干扰细胞内过程、调节先天免疫反应、抑制与疾病相关的 miRNA 和蛋白质,并用作反义 RNA 和翻译的模板,以及作为治疗的靶点和标志物。最近,北京大学的魏文胜教授团队开发了一种新型的环状RNA疫苗,该疫苗通过表达S蛋白的三聚体 RBD 区域在小鼠和恒河猴体内引发了有效的中和抗体和 T 细胞反应;还分别针对德尔塔和奥密克戎研发了两种不同的疫苗,结果显示针对德尔塔的疫苗具有更大的广谱性。该成果揭示了环状RNA有潜力成为新型的疫苗和治疗平台,一经发表就引发了大家的广泛关注和讨论。
图1 环状RNA疫苗可在小鼠和恒河猴体内提供对新冠变异毒株的有效保护
环状RNA作为一种先进的技术,大家对其产业化的道路和成果也充满了期待。在此,笔者想要浅谈该工艺路线,如有不足之处,欢迎一起探讨。
环状RNA工艺
① 技术要点:RNA环化和表达
在体外合成环状RNA的过程中,环化这一步是我们绕不开的一个槛。目前的有三种常用的环化方法:I型内含子自剪切、Ⅱ型内含子自剪切和T4 RNA连接酶等方法。I型内含子剪切最重要的特点是自我催化,活性依赖于RNA分子中的碱基配对。其中发生了三次的转酯反应,第一次是由一个游离的鸟苷或者鸟苷酸(GMP、GDP、GTP)启动的。Ⅱ型内含子多存在于线粒体中,剪切由内部的腺苷酸引起,之后形成套索结构。T4RNA连接酶可以催化5'-P末端与3'-OH末端之间形成磷酸二酯键,可用于RNA分子间和分子内的连接,也可用于DNA和RNA之间的连接,在形成环状RNA时,对于<1000nt的连接更有效率。
在某些特殊条件下,环状RNA具有被翻译成蛋白质的功能,目前报道的有内部核糖体进入位点(IRES)和N6-甲基腺嘌呤(m6A)修饰等都可以启动翻译。IRES 是一个长为数百个碱基对的基因工程元件,最早在脊髓灰质炎病毒和脑心肌炎病毒中被发现,可直接招募核糖体的 40S 亚基,启动 3’方向 ORF 的翻译。RNA 的 m6A 修饰是在 RNA 分子 A 碱基的第六位 N 元素上加上一个甲基基团,m6A 结合蛋白 YTHDF3 和真核翻译起始因子eIF4G2 的相互作用,将后者招募到含有 m6A 修饰的circRNA,进一步招募 43S 复合物。
如何确认合成的环状RNA,并将他们与线性RNA进行区分是在工艺中需要重点考虑的事情。Sanger测序结合RT-PCR和Northern Blotting (NB)是目前使用比较多的方式。在变性胶图中,环状 RNA 比具有相同序列的线性 RNA 迁移得更慢,我们可以以此来对这两者进行区分。
环状RNA的科研级别的制备技术相对已经成熟,如何进行产业化也成为了业内需要共同跨越的一个难题。我们尝试将其分为两个大的工艺模块,分别是质粒的制备和环状RNA的制备。
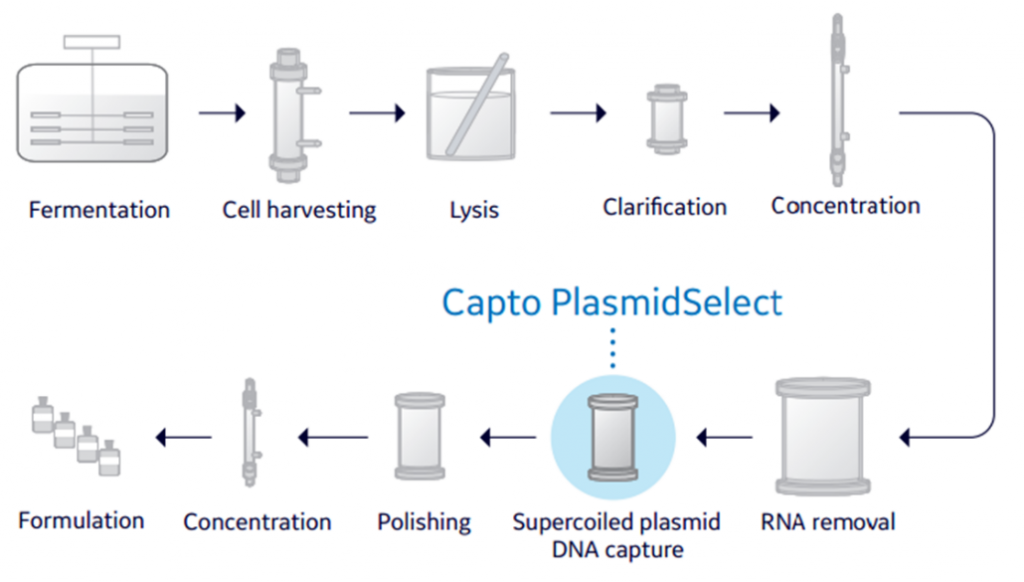
质粒DNA(pDNA)是环状RNA生产中不可或缺的原料,可以用作体外转录的模板。质粒的工业化生产工艺目前已经趋于成熟,可选择外包或者建立平台内部开发,收获一定规模的高纯度超螺旋质粒。需要去除产品相关杂质和工艺相关杂质,控制生物负荷,进行稳健和可全面放大的操作。整体工艺过程包括发酵、菌体收获、碱裂解、澄清、超滤浓缩、层析等步骤,如下图所示。层析步骤中包含了经典的三步纯化,第一步用的填料是一款分子筛的填料Sepharose 6FF,用来除去RNA;第二步是一款为Capto PlasmidSelect嗜硫亲和填料,可以用来分离超螺旋的质粒;第三步是一步阴离子交换层析,用的填料是Capto Q ImpRes,用来去除痕量杂质和内毒素。该工艺经过客户的多年验证,得到普遍认可,是高效、通用、稳健的平台化工艺路线。
图2 质粒的工艺流程图
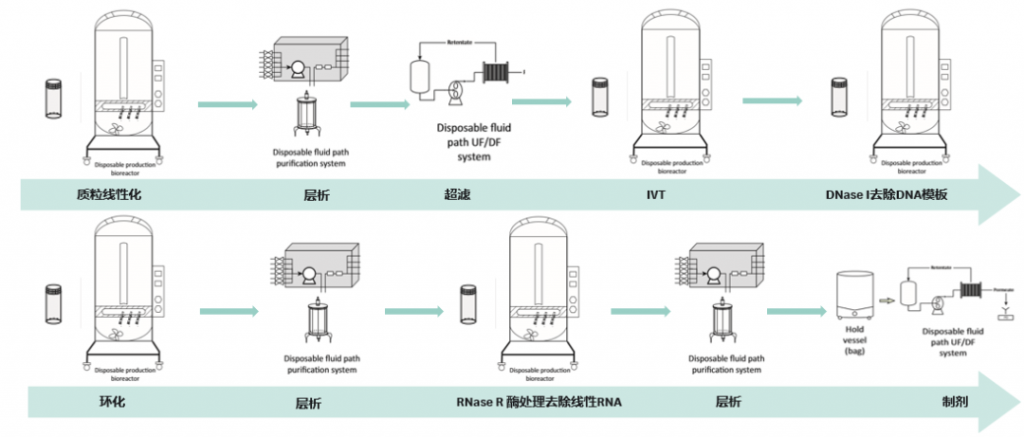
拿到高纯度质粒后,就可以着手制备环状RNA 了。整体工艺可以分为质粒线性化及纯化、体外转录、DNase I去除DNA模板、RNA环化、层析纯化、RNaseR处理、再层析纯化、制剂等步骤,如下图所示:
图3 环状RNA工艺流程图
拿到高质量的质粒以后,第一步需要用限制性内切酶 Bsa I将质粒进行线性化的处理,反应完成之后,可以用层析的方式除掉反应的酶,并将缓冲液置换成后续适合IVT反应的溶液。该步骤和线性mRNA的处理过程是一致的,其目的都是为了得到线性化的质粒以利于后续的IVT和环化。
第二步就来到了IVT的环节,为了在体外得到RNA,大部分的工艺会选择使用T7 RNA聚合酶进行体外转录,得到单链RNA,反应结束后,使用 DNase I去除 DNA 模板,减少对后续反应的影响。
第三步也是环状RNA制备过程中非常重要的一步,即环化过程。如前所述,RNA的环化有三种不同的方式,不同的方式、不同的RNA长度都可能带来不同的环化效率,也是我们在工艺过程中需要重点摸索的一步,环化效率越高,后续的纯化方式就可以越简单。环化完成后,必然伴随着副产物,如T4RNA连接酶或者环化使用的GTP,Linear precursor以及Nicked RNA,这些都是我们要去除的杂质,所以环化以后,使用层析的方式对目的产物进行纯化,便于后续工艺的放大。层析结束后,继续使用RNase R处理,它是一种来源于大肠杆菌 RNR 超家族的 3’-5’核糖核酸外切酶, RNase R 可消化几乎所有的线性 RNA 分子,但不易消化环形RNA,所以经常用于环形 RNA的富集过程。接着继续使用层析,去除还残留的一些小片段的线性RNA和酶,使产品达到一定的纯度。层析所使用的填料,可以根据要去除杂质和目的之间的性质差异来选择,Cytiva可提供多种类型层析填料,如分子筛、Capto Core系列、离子交换、亲和填料等等。
第四步,就进入制剂环节,可以通过超滤的方式将原液置换到合适的缓冲液中。在这些工艺步骤中,从质粒到环状RNA,从实验室级别的工艺开发,到GMP级别的生产放大,Cytiva可提供全流程的一站式解决方案,助力行业快速发展。
以上的工艺流程,可以供大家讨论和参考,环状RNA的研发和产业化道路还存在诸多的挑战,我们希望建立一个简单、快速、可重复、可放大的高效生产环状RNA的工艺平台,加速这一非凡疗法的产业化之路




来第一个抢占沙发评论吧!