原创:转化医学网
作者:Sophia
导读:环状RNA(circRNAs)是基因表达研究中最有前途的,近年来的研究数量呈爆炸式增长。环状RNA(circRNA)是真核细胞中稳定且普遍存在的RNA,大多数由前体mRNA外显子反向剪接(back-splicing)产生。
发表在《Nature Biotechnology 》杂志上的一份新报告中,Robert Chen和美国加利福尼亚州斯坦福大学的一组跨学科研究人员开发了一种系统的方法,可以快速组装和测试基于合成环状RNA影响蛋白质生产的特征。该团队通过优化精细元素,最大限度地提高了环状RNA的翻译,以实现设计原则——将环状RNA的产量提高了几百倍。与信使RNA(mRNA)水平相比,该结果促进了感兴趣的RNA的翻译增加,从而在体内提供持久的翻译。
https://www.nature.com/articles/s41587-022-01393-0
开发环状RNA(circRNA)
01
基于RNA的疗法跨越信使RNA(mRNA),小干扰RNA(siRNA)和microRNA(miRNA),并扩展到现代医学,包括小分子,生物制剂和细胞疗法。例如,最近流行的mRNA疫苗可以在实验室中设计并快速开发,以应对不断发展和紧迫的医疗危机。编码RNA可以变为circRNA以延长蛋白质翻译的持续时间,基于RNA分子。生物工程师还推进了循环长转录本合成circRNA。然而,由于在循环RNA上,缺乏7-甲基胍酸盐7G)。研究人员需要彻底检查环RNA翻译的原理,以建立更好的疗法,并有可能超越mRNA的翻译能力。为了研究这一方面,该团队开发了一个模块化的高通量平台来构建和测试合成的圆形RNA,以优化翻译并提高蛋白质产量。
模块化的 circRNA 组装平台
02
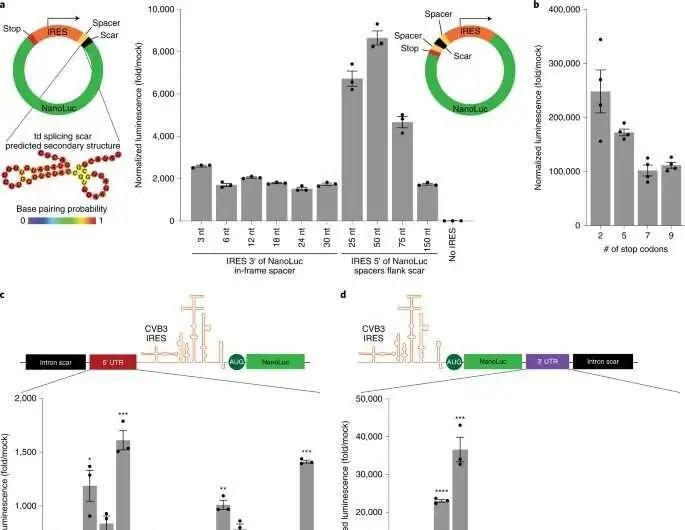
科学家们开发了一个模块化的克隆平台,该平台由一组与金门和Gibson克隆兼容的部件组成,可以对circRNA进行更高通量的测试。通过该平台,他们确定了环状RNA设计的特定方面如何影响其翻译。例如,该团队之前已经展示了如何通过用m6a修饰分子来避免环状RNA触发的免疫反应。然而,研究人员仍然必须了解这一步对环状RNA翻译的影响。为了解决这个问题,陈和团队使用了他们的克隆平台,并合并了m6a。与未经修饰的环状rna相比,含有5%m6A的环状RNA在体外转染或电穿孔后表现出相同的翻译。因此,科学家们通过实验测量了该修饰对环状RNA稳定性的影响。
circRNA动态
03
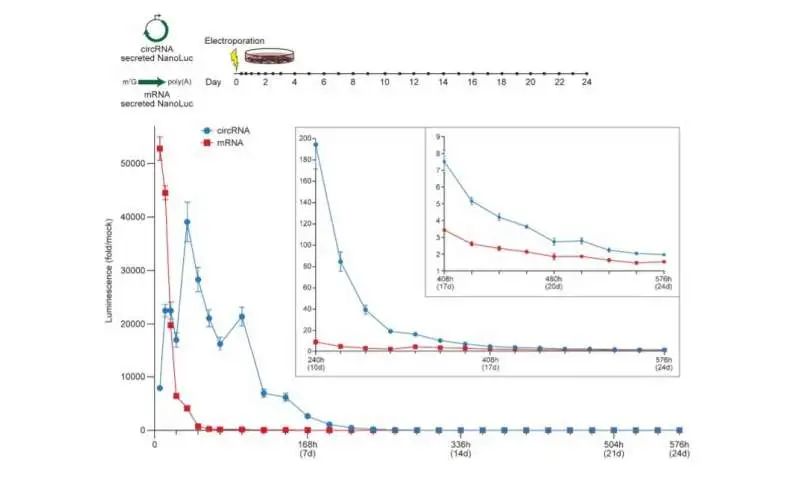
为了揭示强翻译所必需的circRNA载体拓扑结构的原理,研究人员开始合成circRNA以产生具有该过程编码的肽的变体。根据结果,研究小组表明,增加间隔长度对翻译不利。接下来,他们展示了5'和3'未翻译区域是如何改善circRNA翻译的。研究人员还进行了一系列实验来检查circRNA优化,然后在单个实验中对其进行比较。他们展示了这些变化如何在不影响RNA产量或环化效率的情况下逐渐增加circRNA的表达。他们还展示了circRNA和mRNA翻译的动力学如何显著不同,其中circRNA需要超过24小时才能达到其最大翻译长度,远远超过mRNA的翻译持续时间。然后,他们结合一系列circRNA优化来测试它们在体内的表达。为了递送RNA,研究小组用电荷改变可释放转运蛋白(CARTs)或介导小鼠模型中mRNA表达的阳离子分子配制它们。结果表明,工程化的circRNA在体内的表达强度与修饰RNA相似,尽管持续时间更长。
展望
04
通过这种方式,Robert Chen和同事展示了RNA循环化如何通过延长相对高度瞬态分子的持久性,来改变基于RNA药物的巨大潜力。鉴于环状RNA和mRNA翻译机制之间的根本性差异,现有的最大化mRNA翻译的知识并不一定会转化为环状RNA。为了促进这项研究,该团队创建了一个circRNA模块化克隆平台,以测试多种序列变异和多个参数的优化。利用该平台,他们确定了几种改善circRNA蛋白质翻译的方法,并广泛应用于工程环状RNA,在体外产生比mRNA更多的蛋白质,并在体内和体外表现出更高的翻译耐久性。科学家们系统地解剖了调节环状RNA翻译的元素,然后优化感兴趣的区域,以增加环状RNA蛋白的产量,从而在体内持久的产生蛋白质。
参考资料:
https://www.nature.com/articles/s41587-022-01393-0
https://phys.org/news/2022-08-circular-ribonucleic-acids-circrnas-protein.html







来第一个抢占沙发评论吧!