作者:耀海生物
y前言环状RNA (circRNA)是一类单链闭合的环状RNA分子,由mRNA前体(pre-mRNA)通过可变剪接(AS, Alternative Splicing),外显子环化或内含子环化)产生,内源性环状RNA包括编码或非编码性RNA,不包含5'端帽结构和3'端poly(A),缺乏游离末端,因此不易被核酸外切酶降解,比线性RNA更稳定。20世纪70年代,研究者在植物类病毒中首次发现circRNA,随后在多种病毒、小鼠和人类等真核细胞内发现circRNA的存在。随着生物信息学和测序技术的发展,研究人员检测到circRNA在真核细胞中广泛存在,circRNA的调控和编码功能也逐渐被深入研究。接下来,菌菌将围绕circRNA的发展史、基础研究和治疗应用展开阐述。
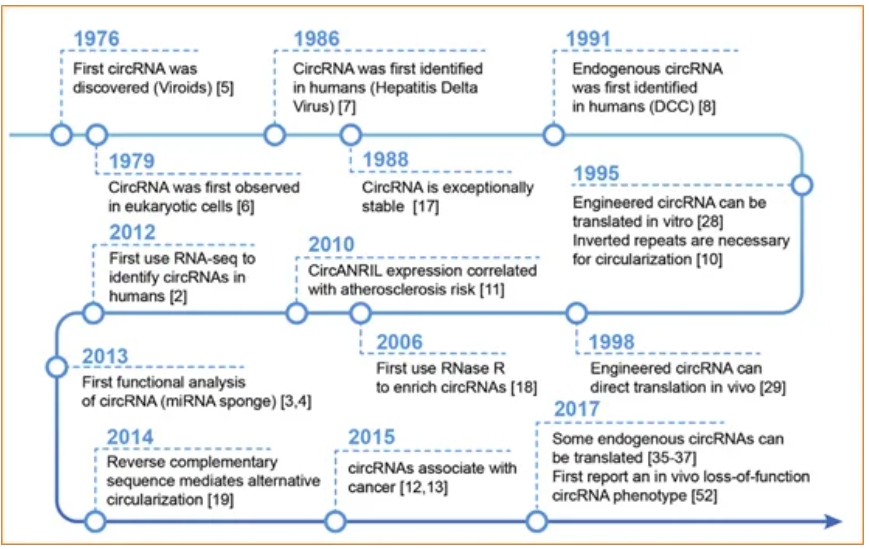
一、circRNA的发展史
如下图所示,1976年,有学者在植物类病毒中首次发现单链闭合的circRNA。1979年,借助电子显微镜可观察到真核细胞质中存在circRNA。随后的几年,研究者先后在人丁型肝炎病毒和人体细胞中鉴定了circRNA,并发现circRNA不易被RNA外切酶降解,结构较稳定。1995年,研究报道在内部核糖体进入位点(IRES)的助力下,可实现工程化circRNA的异源表达。2010年至2015年期间,有研究报道了circRNA在代谢性疾病和肿瘤相关通路中发挥一定的调控作用,且发现了circRNA作为miRNA海绵的功能。直至2017年,circRNA可编码蛋白质的功能在多篇文章中报道。
二、环状RNA(circRNA)的基础研究
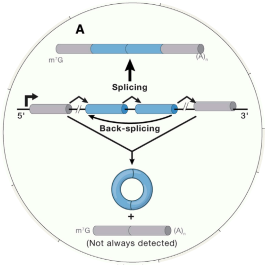
1.环状RNA的形成方式经典的线性RNA剪接方式(Spicing),通过识别内含子中的5’端剪接位点(GU)和3’端剪接位点(AG),将前后外显子首尾相连,剪接产物为成熟的mRNA,具有5’端帽结构和3’PolyA尾。而环状RNA剪接方式为Back-spicing,通过特异性反向剪接,后面外显子的尾端与前面外显子的前端相连,产生的circRNA没有5’端帽结构和3’端PolyA尾,由一个或者多个外显子构成,部分circRNA也包含内含子。
2.环状RNA的分类
根据circRNA序列来源,可以把circRNA分为四类:①EciRNA(Exonic circRNA)是来源于母基因外显子的circRNA;② ciRNA(Intronic circRNA)是来源于内含子的套索型circRNA;③ EIciRNA(Exon-intron circRNA)是来源于外显子和内含子的circRNA;④ Antisense circular RNA是来源于反义链转录本的反义circRNA,Intergenic circular是来源于基因间序列或其他未注释基因组序列的circRNA。
绝大多数的circRNA属于外显子类型的circRNA,保守性较其他种类的circRNA也更高。
3.环状RNA的主要生物学功能
circRNA的调控作用:circRNA可与亲本DNA基因座、miRNA、mRNA或蛋白质结合,调控基因的表达和信号通路。除调控作用外,circRNA也可作为蛋白翻译的模板,借助IRES、m6A和其他序列元件启动蛋白的翻译,包括内源或外源性蛋白。其生物学功能详细介绍如下:
调控转录与剪接:例如,ci-ankrd52与亲本基因座结合,形成R-loop,激活RNase H1介导ci-ankrd52酶切,破坏R-loop,促进转录延伸。circSEP3与亲本的DNA基因座形成R-loop,导致转录暂停,产生外显子跳跃突变体。
蛋白海绵:circMbl与MBL蛋白的反馈调控,MBL可结合在circMbl内含子的侧端,促进circMbl的合成;同时高表达的circMbl会吸附MBL蛋白,影响MBL靶向其他通路的功能。
调控免疫:部分circRNA会形成较短的dsRNA区域,可结合并抑制细胞中dsRNA活化蛋白激酶R(PKR),调控免疫反应。
circRNA与蛋白质结合形成RNA-蛋白复合体,调节信号通路。
miRNA海绵:含有多个miRNA结合位点,可作为竞争性内源性RNAs(ceRNAs),吸附miRNA,从而调节miRNA对靶mRNA的作用。
与mRNAs相互作用:circRNA可以与mRNA结合,影响mRNA的稳定性和翻译。
与蛋白结合:circRNAs与蛋白质的结合能力强于线性mRNA,从而影响mRNA的翻译,发挥竞争性结合的功能。
作为多肽或蛋白质的翻译模板:除调节基因表达的非编码作用外,circRNA以非帽结构依赖的方式,借助于IRES启动蛋白质的翻译,circRNA的甲基化修饰m6A也可以驱动circRNA翻译合成蛋白质,circRNA还可以利用其他的序列元件(如:IRES-like elements)来启动翻译。
三、环状RNA(circRNA)的治疗应用
1.环状RNA用于基因的调控(非编码功能)
circRNA的结构、稳定性和免疫原性不同于线性RNA,人们尝试开发基于circRNA的生物技术,基于circRNA的特性,其在生物医学的潜在应用包括:
- circRNA适配体可以招募荧光传感器和有效代谢物生物传感器。
- circRNA作为miRNA海绵,竞争性吸附miRNA,阻断其对mRNA的抑制。
- 合成包含目标蛋白反应元件的circRNA,作为蛋白海绵调节蛋白的活性。
- 反义修饰的circRNA靶向病毒基因组的保守区域,可阻断病毒的传播;或靶向mRNA募集ADAR进行RNA编辑。
- 自剪接产生的circRNA促进细胞内RIG-I表达和PKR激活,诱导先天性免疫级联。
- 含有短dsRNA区域的circRNA无细胞免疫原性,是参与内在免疫反应的PKR的有效抑制剂。
- circRNA的产生具有组织特异性,靶向病理或疾病相关的circRNA可作为疾病诊断的生物标志物。
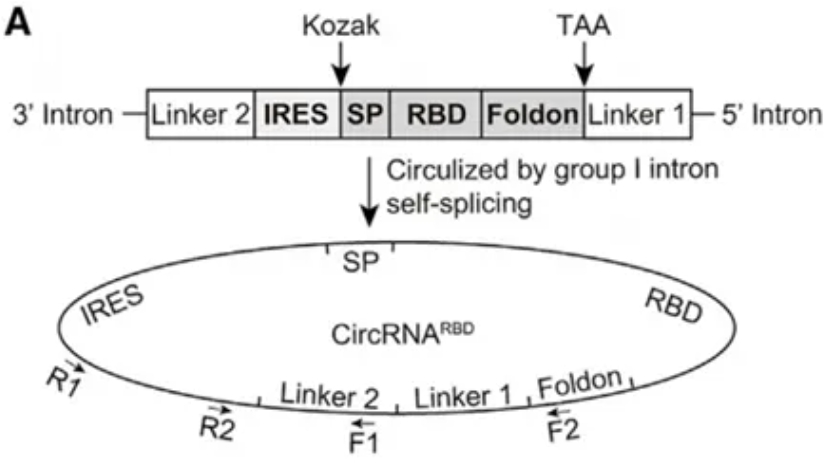
2.环状RNA作为蛋白的翻译模板(编码功能)基于circRNA的结构稳定性、低免疫原性与蛋白翻译功能,circRNA代表了一种新的基因表达平台,可作为mRNA药物的增强或替代。研究人员可通过适当的序列设计和体外制备,编码任何感兴趣的蛋白。2022年3月,北大魏文胜课题组在《Cell》发表研究性论文:Circular RNA Vaccines against SARS-CoV-2 and Emerging Variants。作者基于环状RNA(circRNA)疫苗平台,选择刺突蛋白(spike protein, S蛋白)的受体结合域(RBD, receptor-binding domain)三聚体作为目标抗原,经序列设计、模板制备、体外转录(IVT)、环化、纯化后得到高度稳定的circRNA,并成功地在小鼠和恒河猴中诱导针对SARS-CoV-2的中和抗体和特异性免疫反应。研究还尝试利用circRNA技术,编码SARS-CoV-2特异性抗体或hACE2诱饵(病毒受体),验证了这一策略可有效中和SARS-CoV-2假病毒。
图4 circRNA的序列设计(编码新冠S蛋白RBD三聚体)
除表达病毒抗原或病毒受体外,circRNA平台可通过在体内编码治疗性抗体,如PD1/PD-L1抗体,发挥抑制肿瘤的功能。与抗体和蛋白类药物相比,circRNA药物具有以下优势:可在细胞质编码治疗性抗体,且能绕过细胞膜屏障靶向细胞内靶点,如TP53和KRAS。
四、结语
如Laronde公司所言,circRNA是一种新的“程序化药物”,其潜能无限,可在体内表达任何治疗性蛋白,可能会取代或增强现有的药物使用模式。由于独特的优势,环状RNA(circRNA)吸引了生物公司的布局。据公开资料显示,国内外几家公司加入了circRNA治疗平台的开发队列,包括Orna Therapeutics、Laronde、圆因生物和环码生物。国内药物合同研发(CRO)公司有耀海生物、吉赛生物。从产品管线来看大多基于circRNA的蛋白编码功能,利用Ⅰ/Ⅱ型内含子的自剪接或T4连接酶实现RNA的体外环化,可编码蛋白包括新冠S蛋白、CD19嵌合抗原受体、肌养蛋白,涵盖传染病、肿瘤和遗传病领域。日前,默沙东与Orna Therapeutics宣布了一项合作协议,基于Orna环状RNA平台,共同开发多款疫苗和治疗性药物,Orna可获得高达35亿美元的里程碑款项。此外,默沙东将在Orna的B轮融资中投资1亿美元的股权。Laronde、圆因生物和环码生物也受到资本的青睐,获得高额融资。对比国内外环状RNA领域的企业,大家差距并不遥远,相信在不远的将来,环状RNA技术将成为科研与工业领域的热门,建立一种全新的药物平台。作为CXO相关企业,菌菌希望能贡献一己之力,助力环状RNA早日实现产业化,期待相关科研成果尽快步入临床。
参考文献
[1] Liu CX, Chen LL. Circular RNAs: Characterization, cellular roles, and applications. Cell. 2022 Jun 9;185(12):2016-2034. doi: 10.1016/j.cell.2022.04.021.
[2] Qu S, Liu Z, Yang X,et al. The emerging functions and roles of circular RNAs in cancer. Cancer Lett. 2018 Feb 1;414:301-309. doi: 10.1016/j.canlet.2017.11.022.
[3] Yang L, Wilusz JE, Chen LL. Biogenesis and Regulatory Roles of Circular RNAs. Annu Rev Cell Dev Biol. 2022 May 24. doi: 10.1146/annurev-cellbio-120420-125117.
[4] Qu L, Yi Z, Shen Y, et al. Circular RNA vaccines against SARS-CoV-2 and emerging variants. Cell. 2022 May 12;185(10):1728-1744.e16. doi: 10.1016/j.cell.2022.03.044.





来第一个抢占沙发评论吧!