作者:新使生物
环状RNA(circRNA)是通过反向剪接形成的共价封闭单链环,与线性mRNA不同,circRNA没有5’和3’末端,不易被外切酶降解,半衰期较长。circRNA具有复杂结构,能充当microRNA海绵、抑制或调节蛋白活性,甚至作为翻译模板。由于其特定的表达模式和稳定性,circRNA有望成为疾病生物标志物。
circRNA存在于多种体液和外泌体中,在人体和病原体基因组中普遍存在。它们可以触发强效的免疫反应,并被用于开发针对传染病和癌症的疫苗。
许多物种能从环境中摄取dsRNA以启动RNA干扰。树突状细胞(DCs)和巨噬细胞可以摄取mRNA。研究表明,DCs主要通过胞饮作用吞噬mRNA,而巨噬细胞通过清道夫受体和受体介导的吞噬作用摄取pDNA。
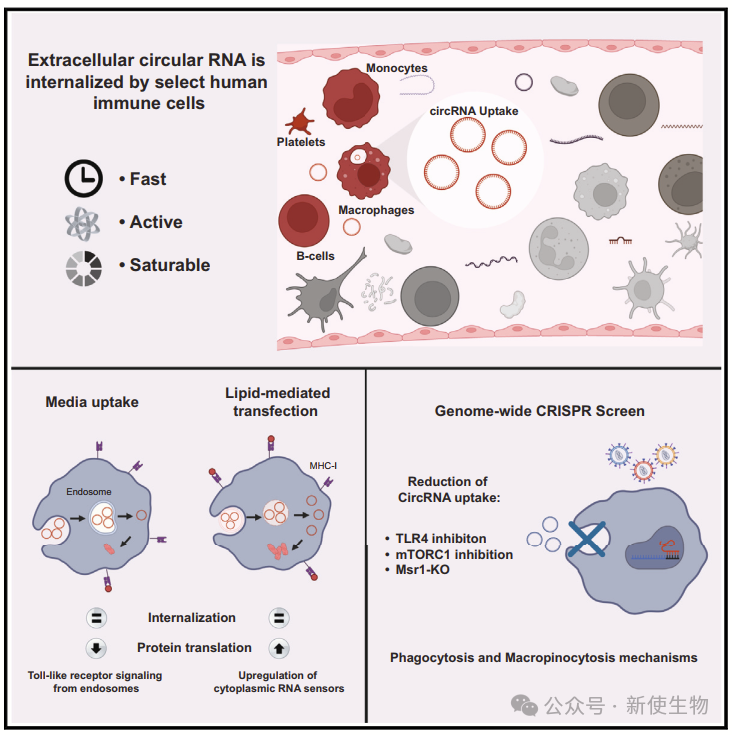
在研究circRNA疫苗过程中,研究团队发现系统性给予裸露外源circRNA可以在小鼠中引发强效的抗原特异性免疫反应,皮下注射后导致其在巨噬细胞和DCs中被摄取,并运送到引流淋巴结和脾脏。这些有趣的观察是在整体水平上的,但这种效应的详细机制仍然是个谜。
2024年5月17日,美国斯坦福大学Howard Y. Chang团队在Molecular Cell上发表了一篇题为“Pathways for macrophage uptake of cell-free circular RNAs”的论文,文章旨在研究与细胞外游离circRNA摄取路径相关的细胞机制和免疫反应,揭示了细胞游离circRNA被巨噬细胞摄取的前所未见的途径。这一发现不仅揭示了驱动circRNA佐剂特性的神秘机制,而且对于RNA治疗领域的发展具有重大潜力。
【标题】Pathways for macrophage uptake of cell-free circular RNAs
【发表期刊】Molecular Cell
【发表日期】2024年5月17日
【作者及团队】美国斯坦福大学Howard Y. Chang团队
【IF】15.58
研究结果
一. 细胞类型特异性摄取胞外circRNA
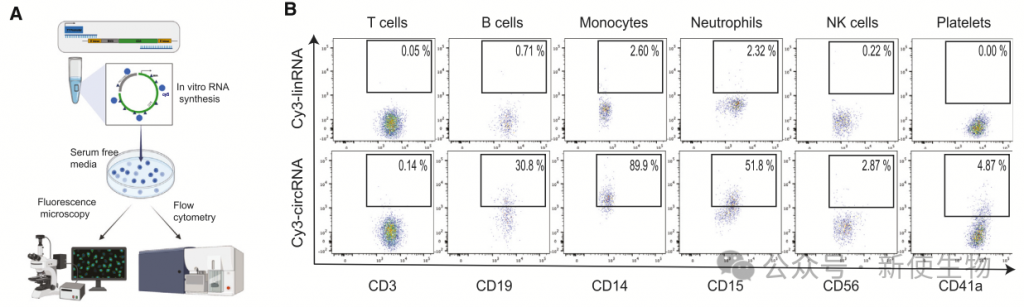
作者研究了人类血细胞对circRNA的摄取,使用荧光标记的体外转录circRNA,并通过逆转录定量PCR验证其环化效率和纯度。
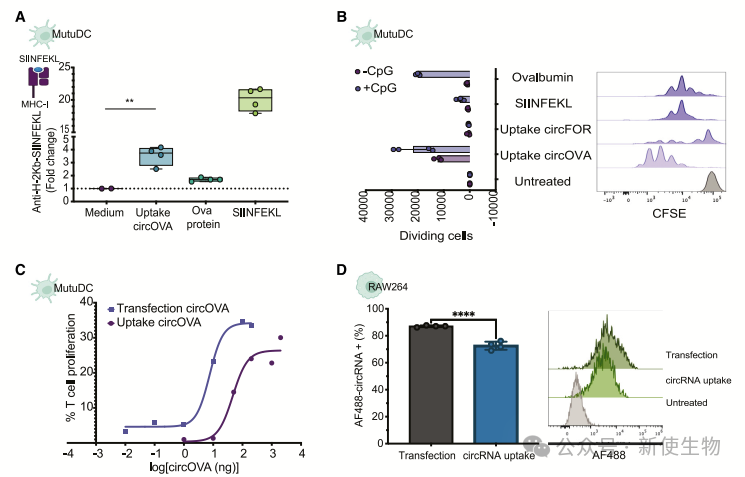
将荧光标记的circRNA添加到人类外周血单核细胞(PBMCs)中,孵育2小时后通过流式细胞术分析。结果显示,单核细胞、中性粒细胞、B细胞和血小板内化circRNA,其中单核细胞摄取量显著更高,90%的单核细胞在2小时内呈现荧光标记。相比之下,线性RNA的摄取量要低20至40倍。
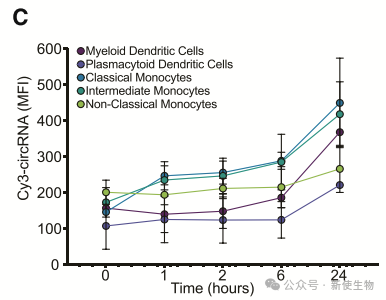
进一步分析显示,经典单核细胞在24小时内表现出更高的circRNA摄取量。
综上,多种人类免疫细胞类型能够摄取胞外circRNA,验证了小鼠体内裸circRNA递送的观察结果。
二. 巨噬细胞能够高效且剂量依赖性地摄取circRNA
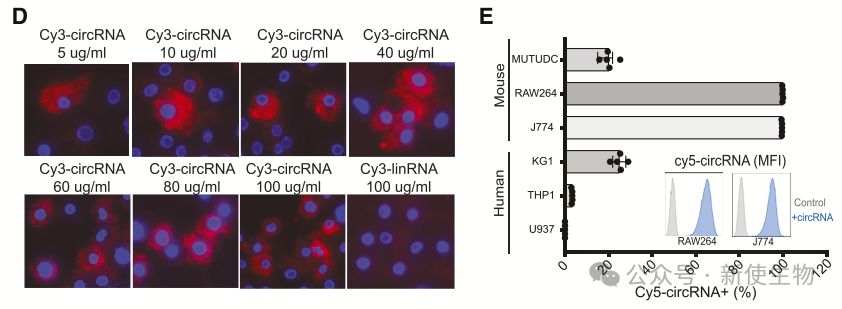
荧光显微镜显示,巨噬细胞以剂量依赖方式摄取circRNA,饱和浓度为40 µg/mL,且主要在细胞质中检测到,相比之下,线性RNA则未被摄取。
低剂量时,单个巨噬细胞优先摄取circRNA;高剂量时,更多巨噬细胞开始摄取。
不同细胞系中,分化的巨噬细胞系和树突状细胞系摄取最强。circRNA的摄取与浓度正相关,并且在肝癌、肺上皮和肺成纤维细胞系中也显示出较强的摄取能力。
三. 巨噬细胞对circRNA的摄取快速、可饱和且依赖能量
为了研究circRNA摄取机制,作者研究了巨噬细胞的内化动力学。Cy5-circRNA在5分钟内被摄取,并在24小时内持续增加,在1 mM浓度时达到饱和。竞争实验显示,未标记circRNA、线性RNA或pDNA能有效竞争Cy5-circRNA的摄取。
温度依赖性实验表明,circRNA摄取是能量依赖的。ATP抑制剂处理后,摄取显著减少,PMA和LPS刺激能增强巨噬细胞对circRNA的摄取。
四. DCs对circRNA的摄取导致其翻译并呈递给T细胞
circRNA摄取的另一个指标是其潜在的蛋白质翻译能力。为了确定circRNA摄取后是否能够被翻译,作者设计了两种circRNA分子,一种编码抗原鸡卵清蛋白(circOVA),另一种编码报告蛋白纳米荧光素(circNanoLuc)。
由于circRNA没有5’端,它们利用内部核糖体进入位点(IRES)实现翻译,研究团队使用了一系列优化元素来提高circRNA的翻译效率。
为了确定circRNA是否可以被翻译并加工成抗原,并通过DCs呈递,作者在与circOVA共培养后测试了MutuDCs的抗原呈递能力。实验结果显示,circOVA摄取后可增强特定抗原的T细胞增殖,并且转染circRNA后所需的输入量大幅减少。
这些发现表明circRNA可以在细胞内被摄取和翻译,并且编码的蛋白质可以被加工并呈递给免疫系统。
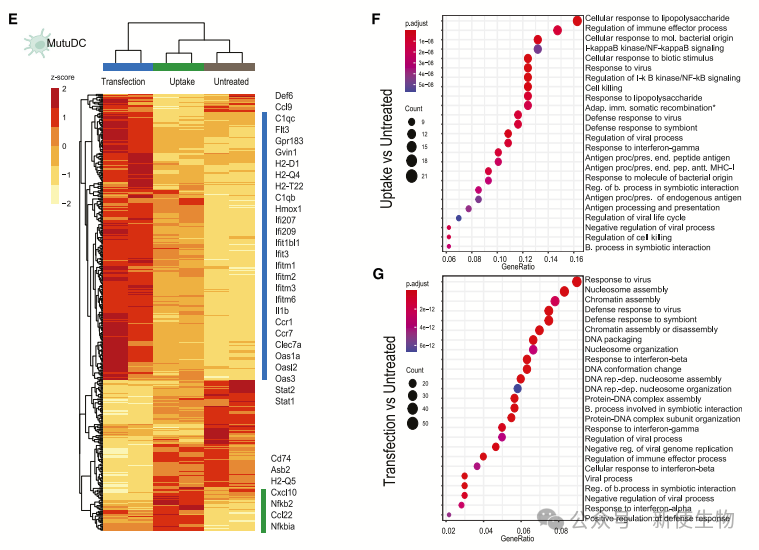
五. circRNA激活不同的转录程序
作者通过RNA测序比较了单纯circRNA摄取和脂质介导转染后细胞的转录组谱。结果显示,这两种方式导致了不同的转录谱,表明circRNA进入路径的差异导致了明显的转录调控。
尽管单纯的circRNA摄取后的翻译效率较低,但仍激活了免疫应答。这些结果表明circRNA的内化方式影响其在细胞内的定位和识别,进而影响免疫系统的响应。
六. CRISPR筛选鉴定了circRNA摄取的调节因子
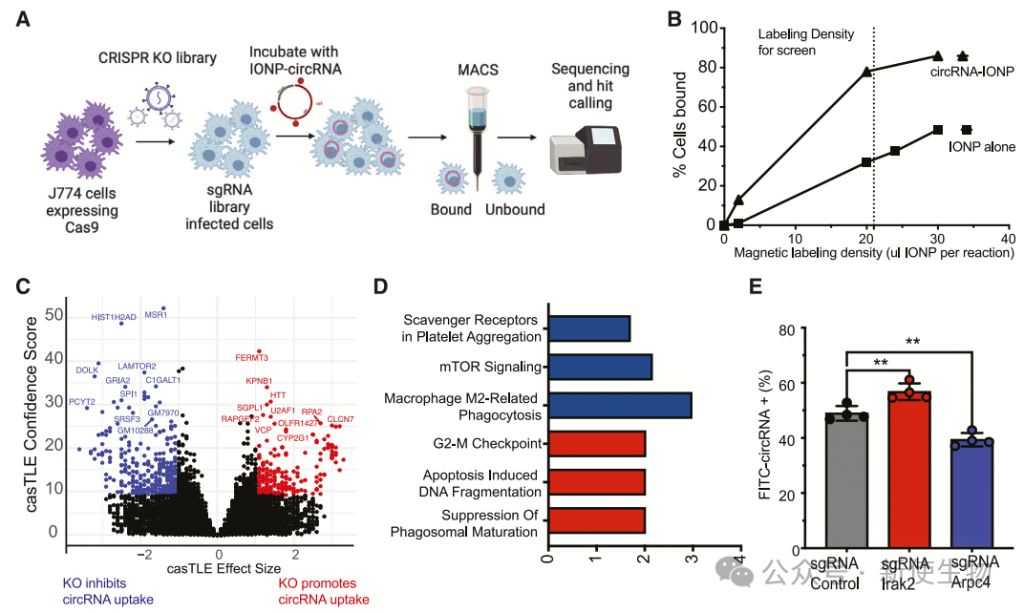
研究表明,在DCs中抑制大胞饮会停止RNA的摄取。为了了解RNA摄取的分子机制,作者使用了CRISPR筛选方法。
通过将Cas9稳定表达在J774细胞中,作者引入了针对基因组中每个编码蛋白的sgRNA文库。他们发现,将circRNA与外来物体结合后,它会作为巨噬细胞的摄取信号。
通过将circRNA与铁氧化物纳米粒子(IONP)结合,可以富集摄取circRNA的巨噬细胞。通过CRISPR筛选,团队鉴定了几十个调节circRNA摄取的基因。这些研究揭示了circRNA摄取的关键调控因子。
七. 用于circRNA摄取的受体介导吞噬途径
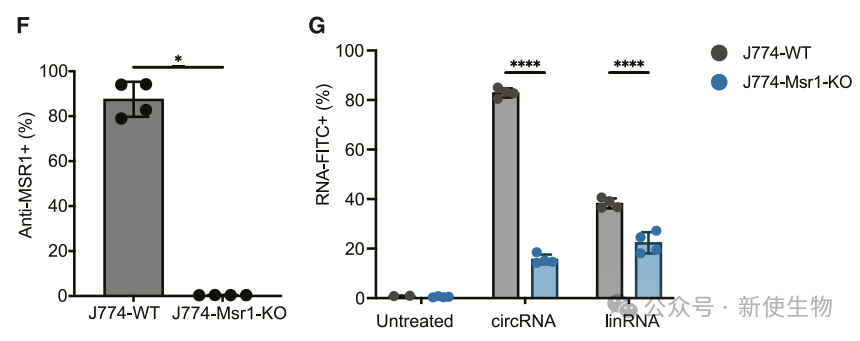
通过基因敲除实验,作者发现Msr1是促进circRNA摄取的主要因子,而Fermt3可能是抑制摄取的因子。Msr1是巨噬细胞的类A受体,与各种配体结合,包括dsRNA,促进TLR信号。
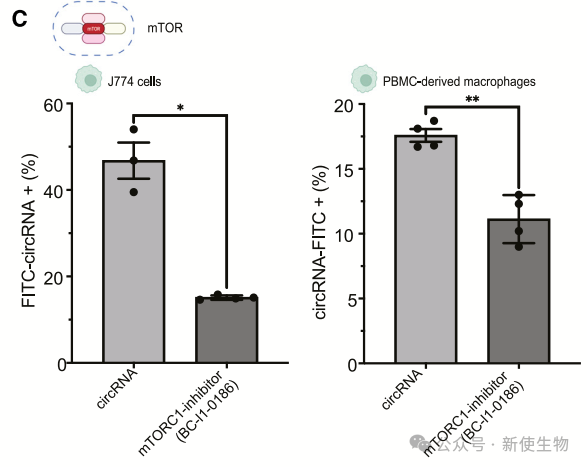
此外,mTOR复合物的成员Lamtor2也参与了circRNA摄取。这些结果表明,circRNA摄取受到多个因素的调控,包括SRs、TLR和mTOR信号通路,以及细胞骨架的重塑。
八. 巨噬细胞的大胞饮也对circRNA的摄取起作用
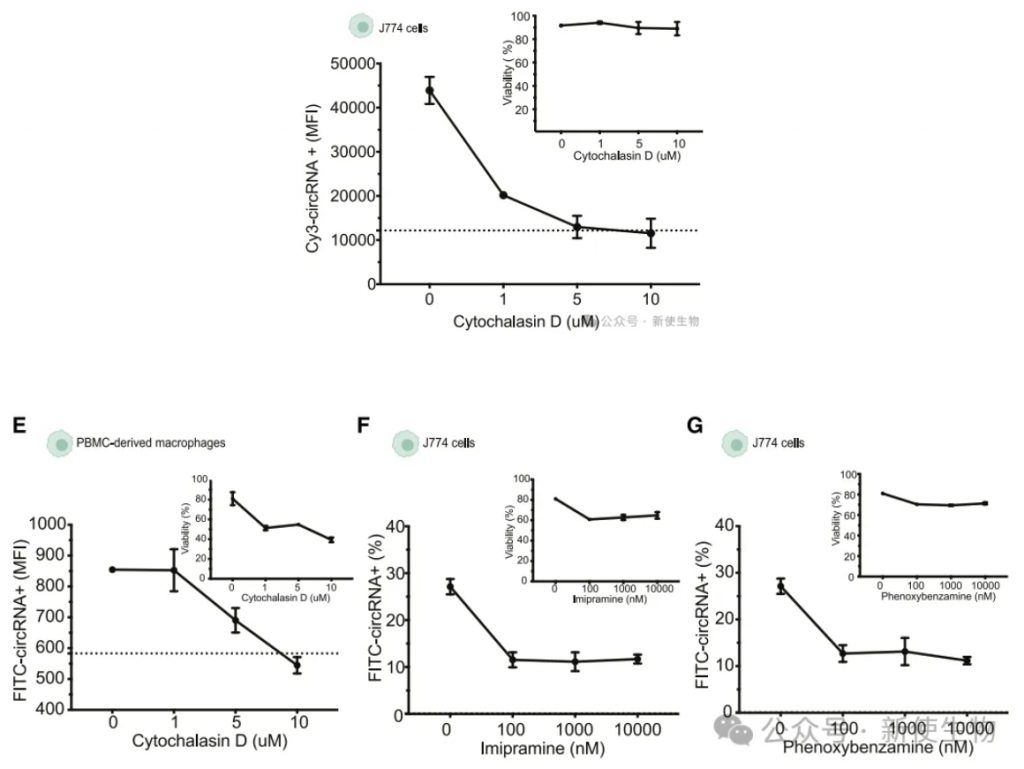
细胞内肌动蛋白聚合参与circRNA的摄取。使用细胞毒素D抑制肌动蛋白聚合导致circRNA摄取减少,而巨噬细胞吞噬抑制剂降低了circRNA的摄取量。
此外,Arpc4的缺失也影响了右旋糖的摄取,表明circRNA的摄取可能受到巨噬细胞吞噬的调控。
在化学抑制剂的作用下,circRNA的摄取方式不同于其他核酸,可能通过SR MSR1介导的受体介导吞噬和巨噬细胞固有的吞噬机制来进行调节。
总结
细胞摄取外源circRNA,特别是巨噬细胞表现出快速、能量依赖性的摄取,可导致编码序列的翻译和抗原呈递。circRNA的摄取途径影响免疫激活,并涉及巨噬细胞清道夫受体MSR1、Toll样受体和mTOR信号通路。本文这些结果揭示了circRNA在细胞内的识别和清除过程





来第一个抢占沙发评论吧!