作者:RNAScript
环状RNA(circRNA)是一类具有共价闭合环状结构的单链RNA分子,没有5′-端帽子和3′-端poly(A)尾巴。circRNA于1976年在植物致病性类病毒中被首次发现,于2012年首次在哺乳动物转录组中被大量发现。
随着天然circRNA的鉴定和功能机制的阐明,它们越来越被认为是细胞生命活动、肿瘤发生和自噬的调节因子,通过复杂的分子机制在生理和病理过程中发挥重要作用。
circRNA在生物体中的发现促使人们通过体外合成来进一步探索它的性质和功能。1994年,人工circRNA被设计出来,当时可以将外来序列放置在外显子中并使用内含子-外显子(PIE)系统在体外形成圆形,证明了体外工程circRNA的可能性。1998年,PIE系统成功连接了含有色荧光蛋白(GFP)开放阅读框(ORF)的线性RNA前体,并在大肠杆菌中正确表达GFP,该策略实现了人工可翻译circRNA的体外合成。
到了2018年,新兴研究优化了PIE系统,以实现更长的体外转录(IVT)线性RNA前体的可行环化,并实现了更高的蛋白质产量。2019年,进一步的研究表明,circRNA仅表现出较低的免疫原性,外源性circRNA中的m6A修饰几乎可以消除其免疫原性。
2022年,研究人员重新优化了circRNA中的非翻译序列,以实现高效准确的蛋白质翻译。这些人工体外合成的突破促使circRNA用于生物医学成为可能。相较于mRNA疫苗而言,包含内部核糖体进入位点(IRES)和开放阅读框(ORF)的circRNA疫苗具有更优的安全性、稳定性、制造简单性和可扩展性。
circRNA疫苗的制备
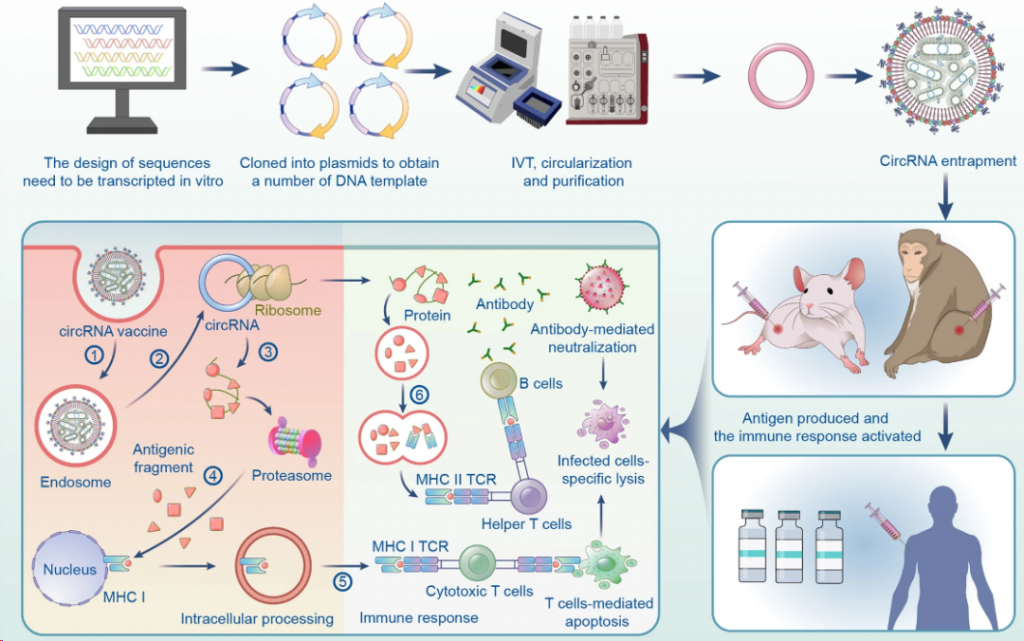
circRNA疫苗的制备主要包括circRNA的设计、合成、纯化、circRNA递送、药效学、安全性评价、生产和临床试验。
▲ circRNA疫苗的制备(图片来源:参考资料1)
circRNA的设计
环化的线性RNA前体(pre-circRNA)需要被设计成包含不同的元件,以构成完整的疫苗特征和功能。
IRES-ORF盒是线性RNA前体的核心元件,IRES介导的翻译很容易通过上游ORF发生,因此IRES和ORF之间需要没有“疤痕”序列,否则会导致翻译效率降低。
设计测序元件以模拟高度结构化的IRES和合适的ORF是设计circRNA疫苗的主要方法。
▲ circRNA设计(图片来源:参考资料1)
circRNA不宜过长,可以通过筛选较短的IRES类似物,如Kozak序列和富含AU的序列来达到缩短circRNA的目的。其次,鉴定短ORF(sORF)或定制ORF以取代长ORF,与较短的IRES起到协同作用。核糖体分析(文库构建)是探索sORF的最佳工具之一,被广泛用于鉴定circRNA中的ORF。
同时,可以通过IRES-ORF盒的上游和下游的设计提高翻译效率,mRNA中的5’和3’UTR可以募集RNA结合蛋白(RBP),从而实现翻译启动。因此,可以设计具有特定基序的这些区域来模仿RBP的结合位点。例如,引入聚结合蛋白基序以触发eIF的结合,引入poly(C)结合蛋白(PCBP)基序以募集核糖体蛋白和反式激活因子,以及m6A基序以诱导YTHDF3和翻译起始因子eIF4G2和eIF3A的募集等。
在优化免疫原性降低方面,可以考虑利用核苷酸m6A修饰;
在促进后续的循环化过程方面,可以在长度为5 kb的线性前驱体中,分别在5’和3’端(切除的内含子片段)和5’和3’剪接位点(驻留的外显子片段)添加外部和内部互补同源臂,可以显著提高循环化效率,或者在剪接位点插入非结构化和非同源的间隔序列等。
circRNA的合成
线性RNA前体通常是使用体外转录(IVT)技术合成。该方法利用噬菌体RNA聚合酶,如T7或SP6 RNA聚合酶,相较于大规模蛋白质生产和纯化而言更简单、更快速、更清洁。在IVT合成后,将线性RNA前体环化的方式是可选的,包括在体外合成circRNA和在体内合成circRNA。
▲ 体外转录技术和线性RNA前体循环化(图片来源:参考资料1)
1.体外合成
主要是化学合成和酶促连接合成。
化学合成
主要以磷酰胺化学和固相合成为基础,并以天然的核苷三磷酸酯衍生物为原材料来进行制备的。不过传统的化学合成方法往往存在低环化问题,且能合成的核苷酸长度一般在70~80nt。近年来,电击化学的应用可能可以克服化学合成策略的固有缺陷,但还待进一步研究。
酶促连接合成
通常可以分为T4连接酶连接和核酶连接两种:前者包括T4 DNA连接酶(T4 Dnl)、T4 RNA连接酶1(T4 Rnl 1)和T4 RNA连接酶2(T4 Rnl 2);后者包括I型内含子自剪接系统、II型内含子自剪接系统、发夹状核酶。
与T4 DNA/RNA连接酶法相比,基于I型内含子PIE法更适合大片段circRNA的合成,且反应条件和纯化方法简单。但这一方法也存在不足之处,如不同的RNA序列会导致最终circRNA域存在很大差异、外源外显子序列的引入会造成最终的circRNA序列与原始的线性RNA前体序列的差异、可能会导致免疫原性等。
2.体内合成
与体外合成不同,体内合成主要采用在活细胞中过表达促进环化的迷你基因序列的质粒载体来实现,可以利用内含子互补序列(ICS)、特定蛋白质结合位点、tRNA内含子、PIE系统等方法合成circRNA。
circRNA的纯化
低免疫原性和蛋白质表达都取决于circRNA组分的绝对均一性,彻底纯化circRNA制剂和检测circRNA纯度至关重要。由于体外合成产物的大小差异,电泳是验证复合物的常规方法,可以简单有效地区分circRNA与线性RNA前体、切口circRNA和剪接中间体。不过这一方法不适用于大规模纯化,电泳会在凝胶和电泳缓冲液中产生热量,从而影响RNA稳定性。
高效液相色谱(HPLC)技术也被用于快速有效地分离RNA混合物。据报道,通过将SEC-HPLC与RNase R消化相结合,扩大了circRNA、切口circRNA、线性RNA前体等产物的特性差异,可以进一步提高HPLC的分离效率,使得circRNA达到90%,这也是目前最为有效的方法之一。不过当下,如何获得纯度高的circRNA仍然是一个有待解决的问题,纯化方法还需要进一步改进。
circRNA的递送
递送系统在有效保护外源性circRNA疫苗并将其运输到目标细胞中起着关键作用。目前,已有多种创新递送策略正在开发中。
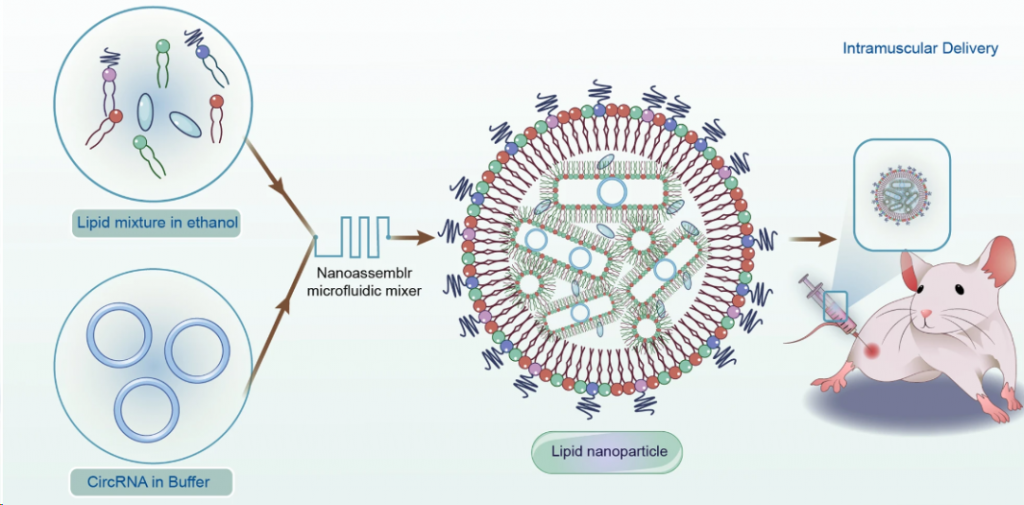
1.基于脂质的递送
LNP具有良好生物相容性和体内递送能力,是富有前景的载体。近期,已经报道了多种新型阳离子可电离LNP递送circRNA的策略。电荷改变可释放转运蛋白(CARTs)是能够介导小鼠mRNA递送的暂时阳离子分子,已经被用于静脉内递送circRNA,在96小时内编码circRNA的能力保持一致。
此外,多臂可电离脂质、AX4基脂质纳米颗粒(AX4-LNP)和FDA批准的LNP用于有效包装和递送circRNA疫苗时,在注射后表现出抗原编码和免疫反应。不过这些递送策略大部分都处于早期研究阶段。
▲ circRNA的递送(图片来源:参考资料1)
2.其他潜在的递送策略
有文章报道过裸circRNA疫苗,通过直接注射circRNA来实现的没有任何递送系统。这一策略依赖于注射部位的抗原呈递细胞(APC)。
真皮中的APC,尤其是DC,可以皮内注射裸mRNA,这取决于DC细胞介导的巨胞作用。随后,在DC的帮助下表达抗原。
在临床试验中,超声引导下经皮将裸疫苗注射到腹股沟淋巴结中也可以引发T细胞反应。这意味着将circRNA注射到淋巴结中可以很容易地实现靶向递送。整体而言,circRNA的递送策略可以参考mRNA疫苗的递送策略。
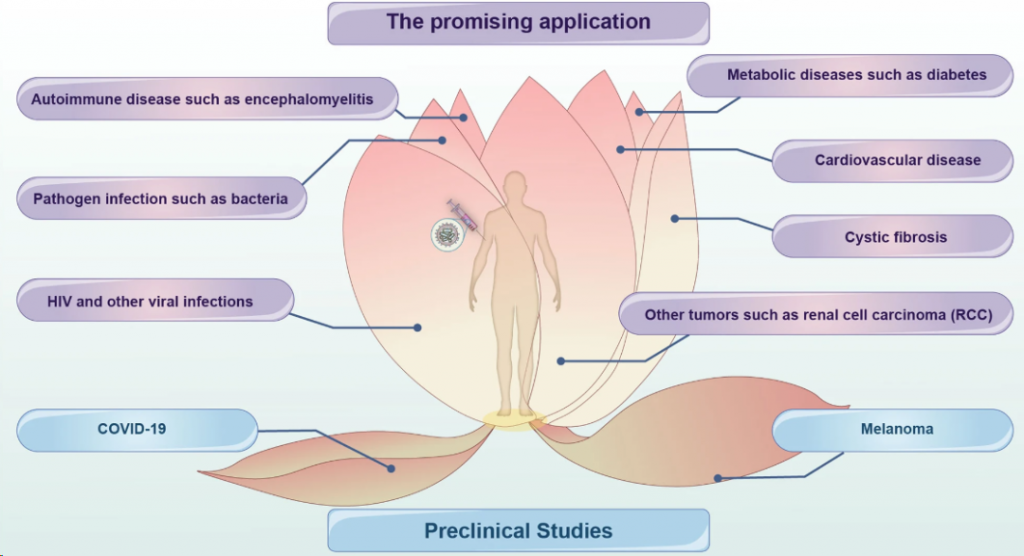
circRNA的潜在应用
随着circRNA的发展,其可能弥补mRNA的缺点,并有可能成为下一代候选疫苗,其有潜力应用于病毒性传染疾病、肿瘤、致病性细菌感染、自身免疫性疾病、代谢性疾病等疾病中。
▲ circRNA的潜在应用(图片来源:参考资料1)
1.病毒性传染疾病
COVID-19在过去几年的传播曾成为全球健康威胁,当下仍需要更具适应性的治疗或预防方法来应对不断演变的SARS-CoV-2病毒及其变体的出现。
有研究报道了治疗SARS-CoV-2及其新兴变异株的circRNA疫苗,其中有2种使用I组内含子介导的PIE系统进行circRNA合成,具有高编码效率和稳定性,人工翻译circRNA的编码寿命远长于相应的核苷修饰的线性mRNA,且可在4°C、25°C或37°C下储存长达28天。
值得一提的是,circRNA可以直接编码抗体来预防病毒感染,其具有应有于基孔肯雅病毒、毒素、艾滋病毒等疾病中的可能性。
2.肿瘤
近年来,肿瘤疫苗已成为抗肿瘤免疫治疗的有前途的策略,表达肿瘤相关抗原(TAAs)或肿瘤特异性抗原(TSAs)的疫苗可以刺激并特异性募集免疫细胞,破坏高表达这些抗原的肿瘤细胞。与其他类型的免疫疗法相比,癌症疫苗理论上可以提供特异性、安全和耐受性良好的治疗效果。
已经有circRNA疫苗用于治疗黑色素瘤的体内研究,利用LNP递送I组内含子介导的PIE系统在体外合成的circRNA,其在小鼠模型中展示出了较好的抗黑色素瘤疗效,同时在肺转移模型中表现出非凡的抗转移潜能。此外,在肾细胞癌(RCC)、胶质母细胞瘤和急性髓系白血病(AML)等已经利用mRNA疫苗验证的肿瘤领域,可以进一步探索circRNA的作用。
3.其他疾病
目前,仍需要做更多的工作来确定circRNA疫苗和基于circRNA的技术在其他疾病中的治疗作用。越来越多的证据表明,基于RNA的治疗平台在自身免疫性疾病、代谢性疾病(如2型糖尿病、心血管疾病和囊性纤维化)中具有疗效,这也为circRNA疫苗将来适应症拓展做了铺垫。
circRNA当下仍处于早期发展阶段,迫切需要开发和完善体外人工circRNA疫苗设计、合成、纯化、递送和治疗应用的先进方法,基于circRNA的新型技术将为疾病治疗和预防开辟新的方向,期待circRNA疫苗成功向临床转化。
参考文献:https://www.nature.com/articles/s41392-023-01561-x
来源:RNAScript






来第一个抢占沙发评论吧!