随着高通量技术日益成熟,越来越多的非编码RNA走入人们的视野。环状RNA(circRNA)以其特殊的结构与多样的生物学功能,日益成为科学研究的宠儿。
有文献报道,circRNA往往作为miRNA海绵体在生物体内以ceRNA的形态出现(Zheng, Q., Bao, C., Guo, W., Li, S., Chen, J., & Chen, B., et al. (2016). Circular RNA profiling reveals an abundant circHIPK3 that regulates cell growth by sponging multiple miRNAs. Nature Communications, 7 11215.),同时circRNA也可以和蛋白产生互作对动脉粥样硬化起到调节作用(Holdt, L. M., Stahringer, A., Sass, K., Pichler, G., Kulak, N. A., & Wilfert, W., et al. (2016). Circular non-coding RNA ANRIL modulates ribosomal RNA maturation and atherosclerosis in humans. Nature Communications, 7, 12429.)。
此外,2016年Cell杂志报道,在人类白血病中,circRNA以融合基因的形态出现,影响白血病的发生与肿瘤细胞的耐药性(Guarnerio, J., Bezzi, M., Jeong, J. C., Paffenholz, S. V., Berry, K., & Naldini, M. M., et al. (2016). Oncogenic role of fusion-circRNAs derived from cancer-associated chromosomal translocations. Cell, 165(2), 289.)。
然而,类似的研究在植物中却甚少报道。2017年4月17日,Nature出版集团的Nature Plants杂志在线以letter的形式在线发表了法国格勒诺布尔阿尔卑斯大学的最新研究成果,详细论证了来源于植物特有的MADS-box转录因子SEPALLATA3(SEP3)的circRNA对母基因转录本的调控分子机制。
研究人员发现,SEP3的第6个外显子形成的circRNA可以显著增加母基因跨越外显子的可变剪切(cognate exon-skipped AS variant,SEP3.3缺乏exon 6)程度,导致植物开花表型变化。并且研究人员发现,这个circRNA可以强烈结合其母基因的DNA基因座,形成一个RNA:DNA杂合体(R-loop)。R-loop的形成可以导致转录的中止,同时招募剪切因子引发对SEP3的可变剪切。这不仅是植物学研究中少数的circRNA分子机制研究的论文,同时也为人们对circRNA的认识提供了新的理解,首次将circRNA与个体器官的表型相结合。在植物学领域与医学领域都具有显著的生物学意义。
重要创新
1. 本工作首次报道了circRNA可以通过参与R-loop的形成调控circRNA母基因转录本的可变剪切,从而影响表型。
2. 本工作首次通过器官层面探索了circRNA的生物学意义。
MADS-box转录因子介绍
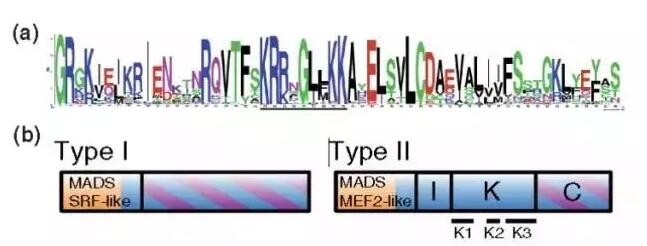
MADS-box基因编码了一类含有MADS-box的转录因子。这类转录因子广泛地参与了生命体尤其是陆生植物的生命活动。MADS-box基因家族含有非常 保守的MADS-box结构域,该结构域可参与与DNA的结合。经过长期的复制与进化,MADS-box基因也被分为两个亚家族,分别为: TypeI(或者SRF)家族以及TypeII (MEF2)家族。其在蛋白序列以及DNA结合上都具有较大的差异(下图)。
MADS类转录因子在高等植物中随着数量的增加,其功能也越来越复杂。 目前对MADS转录因子研究最透彻的是双子叶植物花器官ABCDE模型。ChIP-Sequencing以及ChIP-ChIP实验对 MADS-box蛋白在花的转变过程以及发育过程中的DNA结合位点进行了全基因组的搜索。尤其对一个重要的MIKC类转录因子SEPALLATA3 (SEP3) 的研究发现,植物体内CArG-box只在该蛋白的全基因组DNA结合位点中占到很小的一部分,只有7.7%的结合位点属于典型的CArG-box,17%的结合位点包含 了CArG-box。这意味着CArG-box可能并不是SEP3的最优先的体内DNA结合位点。在SEP3的结合位点中,相当大的一部分属于bHLH和bZIP类转录因子结合 的G-box结构域以及TCP类转录因子结合的CCNGGG结构域,而非CArG-box。
circRNA与可变剪切
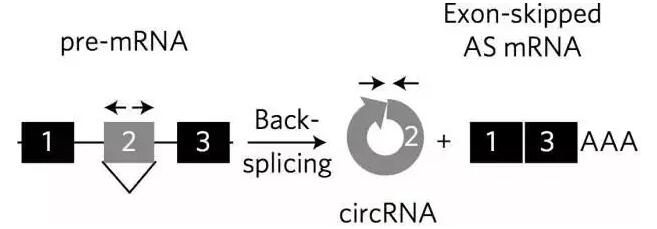
RNA的可变剪切(AS)广泛存在于生物体内。其中,部分剪切后的外显子与内含子的5‘端与3’端结合,形成环状RNA结构。对哺乳动物细胞的RNA高通量测序表明,这些成环的外显子与线性化mRNA跨越外显子的可变剪切密切相关。然而,circRNA的生物合成是跨越外显子的首要条件还是相反却还不为人所知。
图1: circRNA形成原理。
为了研究植物circRNA与AS的关联,研究人员选择了mRNA的可变剪切会产生表型差异的转录因子家族进行研究。植物中,MADS-box家族编码了在植物拟南芥开花以及玉米籽粒发育过程中具有重要作用的一大类转录因子。MADS-box转录因子的可变剪切影响了蛋白互作并且产生表型。在此,作者选择了该家族中SEP3基因来研究circRNA与AS的关联。
对SEP3不同转录本的过表达分析
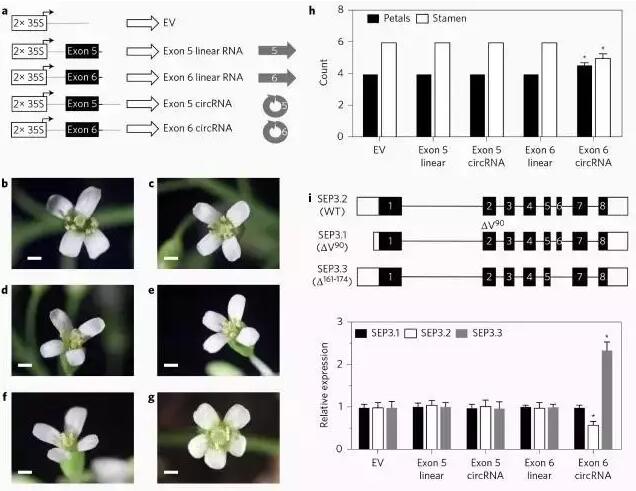
SEP3基因共有3个转录本(图2i),其中SEP3.2为全长转录本,SEP3.1第90个氨基酸缺失,SEP3.3第6个外显子缺失。而SEP3的其中一个circRNA形态就是由第6个外显子成环组成。对这3个转录本5号和6号外显子成环以及线性化的35S过表达转基因株系构建的表型观察发现,只有环状的6号外显子过表达时,拟南芥花的形态发生显著变化(图2a-h)。其中,花瓣数量增加,雄蕊数量减少。对circRNA和母基因转录本的分析发现,只有在环状的6号外显子过表达时,正常的SEP3.2转录本富集数量减少,SEP3.3富集数量增加(图2i)。
图2: 环状RNA过表达的表型观察。
SEP3.3的过表达
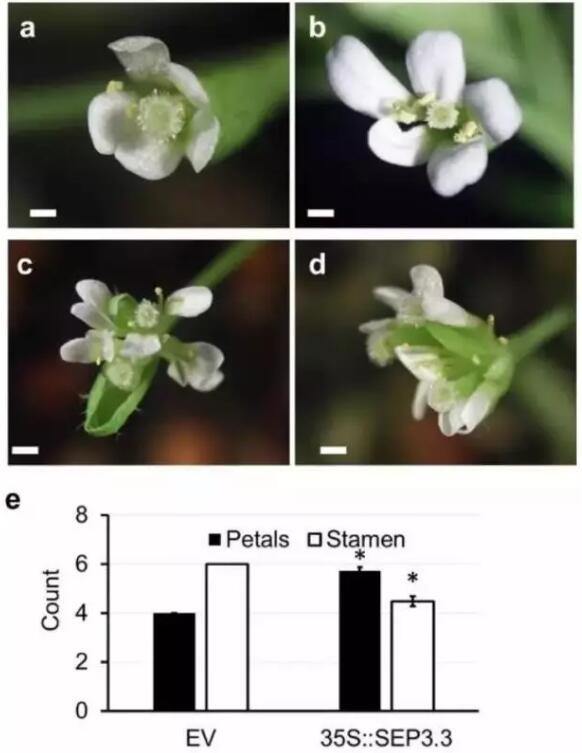
为了确认表型的变化是由于SEP3.3增加导致的,研究人员对SEP3.3进行了过表达实验。结果发现,在体内SEP3.3表达量增加68倍的前提下,植株生长周期显著缩短,开花时间提前4周。SEP3.3过表达的花明显更加健壮,和SEP3 6号外显子circRNA转基因株系表型类似,SEP3.3过表达的雄蕊减少(4.48 ± 0.21, mean ± s.d., P value <0.00001) ,花瓣增多(5.72 ± 0.15; P value < 0.00001) 。综上所述,这证明了SEP3.3的富集和表型外显率之间具有一定的关联性(图3a-d)。
图3: SEP3.3过表达的表型观察。
SEP3 6号外显子circRNA的分子机制研究
在之前的研究中,研究人员通过反向遗传学成功鉴定到了SEP3 6号外显子circRNA。然而,反向遗传学相比较正向遗传学,更加注重表型的观察,因此研究人员还对SEP3 6号外显子circRNA以及SEP3.3过表达株系进行了表型研究。但是,一个完整的反向遗传学工作在确认表型后,依然需要对表型内的分子机制进行研究。因此,研究人员在此通过一些分子生物学和生化的手段来确认SEP3 6号外显子circRNA促进其母基因SEP3.3过量表达的分子机制。
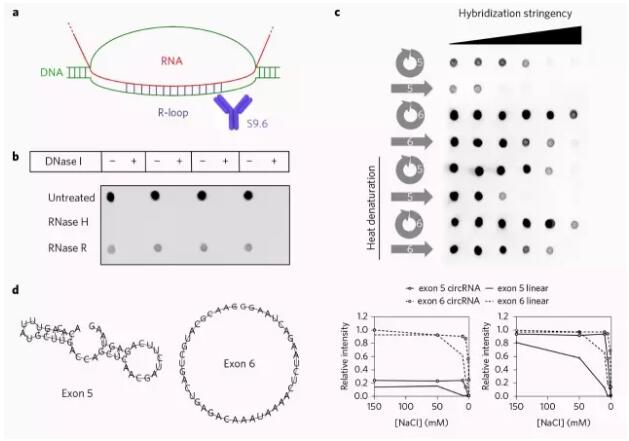
在此,研究人员认为,SEP3 6号外显子circRNA和SEP3.3的调控关联可能是通过RNA:RNA或者RNA:DNA相互作用来实现的。然而,由于SEP3 6号外显子circRNA和SEP3.3均来源于同一转录本,两者缺乏相应的互补序列不能够形成RNA:RNA互作结构,因此研究人员认为RNA:DNA相互作用或者形成R-loop是有较大的可能(图4a)。
图4: R-loop模式示意图。
为了验证这个假设,研究人员使用R-loop特异血清进行了点杂交实验,确认了R-loop的存在(图4b)。并且研究人员还发现,无论是5号外显子还是6号外显子,其环状RNA相比于线性化RNA而言更偏向于形成R-loop的结构(图4c)。而6号外显子相比于5号外显子,更偏向于形成R-loop的结构(图4c)。为了探索其中的原因,研究人员使用RNAfold软件对这两个外显子进行了二级结构预测。结果发现,5号外显子相比6号外显子的结构更加复杂,不利于形成R-loop(图4d)。综上所述,研究人员得出结论,SEP3 6号外显子circRNA通过与SEP3.3的DNA序列形成R-loop,从而延缓转录本的延伸,促进可变剪切的产生。
文章来源:A circRNA from SEPALLATA3 regulates splicing of its cognate mRNA through R-loop formation
解读:测序百乐门(微信公众号)






来第一个抢占沙发评论吧!