非编码RNA是近年研究的热点,从小的siRNA,miRNA到长的LncRNA和circRNA,每一个都在疾病和发育过程中发挥了重要的作用。其中,lncRNA和circRNA的研究起步较晚,现有的研究多是通过高通量测序的方法,在某一疾病体系中寻找差异表达的lncRNA和circRNA,然后通过生物信息学的方法,预测它们可能参与的信号通路。
在预测lncRNA和circRNA的功能机制时,最常用的就是ceRNA分析。ceRNA(competing endogenousRNAs,竞争性内源RNA)是一种RNA与RNA分子间的调节机制。
microRNA可以通过结合mRNA导致基因沉默,而ceRNA,包括lncRNA和circRNA等,可以通过竞争性地结合microRNA来调节基因表达。
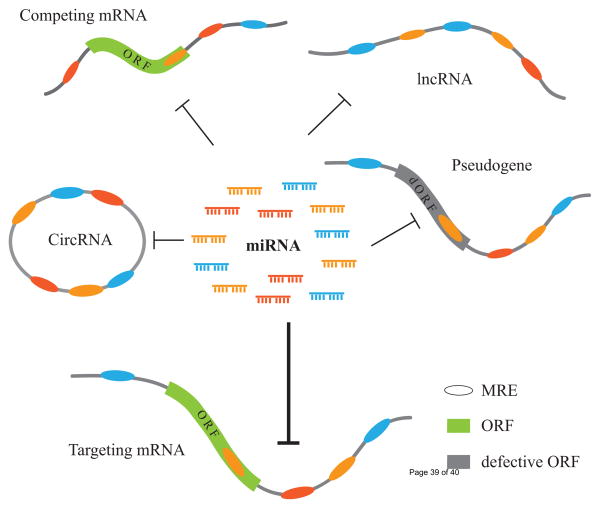
由于ceRNA的预测相对简单,实验也并不复杂,一时间仿佛成为非编码RNA机制研究的捷径,ceRNA的研究发表呈现爆发趋势。
然而,想要真正做好ceRNA的研究并不轻松,也不存在“ceRNA机制已经做得太多,难发好文章”的潜规则,下面,小又就带大家解读Science及其子刊发表的ceRNA研究。
先来解读一篇Science的文章,发得高是因为——同样是ceRNA,但是效果完全不同!!!经典的ceRNA是指circRNA(或lncRNA),通过吸附miRNA,使miRNA不能靶向目的mRNA,从而使目的基因高表达,那么当敲低circRNA(或lncRNA)时,miRNA得到释放,目的mRNA的翻译受阻,基因表达降低。
然而!该研究发现环状RNA Cdr1as可以通过结合mir-7使其保持稳定,不被降解,从而发挥功能,在敲低Cdr1as后,mir-7也降低,目的基因的表达升高!
研究者通过对小鼠大脑的Ago2-HITSCLIP分析,发现Cdr1as可以特异性结合mir-7和miR-671。有趣的是,Cdr1as和mir-7的部分序列互补结合,却可以和miR-671的全序列结合,那么,mir-7可以被Cdr1as吸附,而miR-671却可以切割Cdr1as!
其次,利用CRISPR技术敲除Cdr1as后,发现miR-7明显下降,而其他基因则变化不明显,说明Cdr1as特异性影响与它结合的miRNA。
值得注意得是:研究者得到了Cdr1as KO的纯合小鼠,之后的实验结果均是体内in vivo的结果,而不是简单的用细胞系进行实验验证。
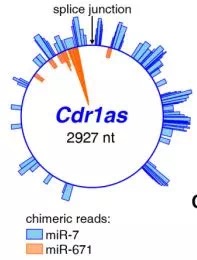
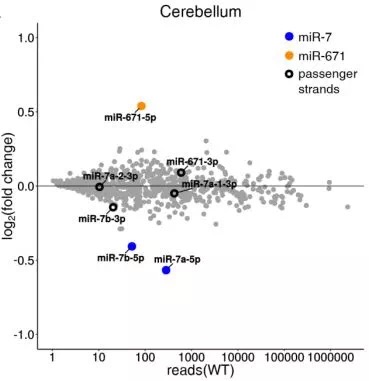
那么,为什么miR-7会在没有Cdr1as吸附后迅速降低呢?是Cdr1as的吸附稳定了miR-7吗?
带着这个问题,研究者检测了敲除Cdr1as后miR-7及其前体pre-miR-7的变化,发现pre-miR-7基本不变,而miR-7显著降低。这说明Cdr1as对miR-7的调节不是在转录水平,而是在转录后水平,Cdr1as通过吸附作用,使miR-7更稳定。
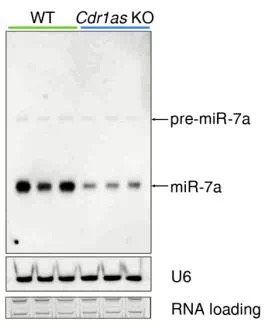
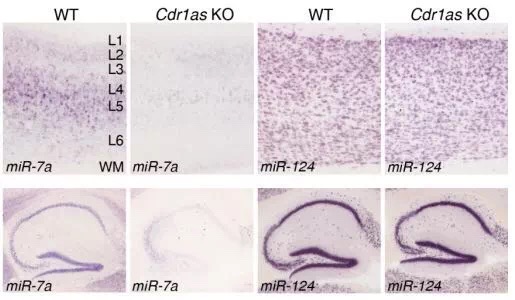
接下来,研究者探究了在Cdr1as敲除导致mir-7下调后,mir-7的靶基因的变化,通过RNAseq分析和western blot验证,发现大量的mir-7靶基因显著上调。这个结果表明Cdr1as通过吸附mir-7,稳定mir-7的存在,抑制mir-7靶基因的发挥功能。
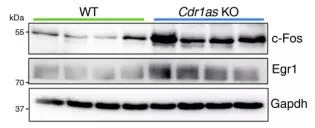
最后就是表型实验了。研究者发现Cdr1as的缺失不会造成小鼠生理行为的太大改变,但是在噪音刺激下,Cdr1as的缺失使小鼠变得迟钝,类似人类的精神分裂症的表现。
该研究的亮点在于:
1.发现ceRNA的新机制!circRNA可以通过吸附miRNA,使miRNA变得稳定,从而降低靶基因的表达。
2.建立了完备的体内实验体系。利用小鼠模型解释了ceRNA的生理意义。
然而,Cdr1as是一个非常特殊的circRNA——有70多个mir-7的吸附位点。而目前鉴定的大部分circRNA和lncRNA不具有如此多的同一个miRNA的吸附位点,并且已报道的ceRNA研究,均发现circRNA和lncRNA对miRNA的吸附,会降低miRNA靶向目的基因的效率,而不是促进miRNA的稳定。
那么,对于这些circRNA和lncRNA,我们又该如何开展研究呢?下面,小又为大家解析一篇SCIENCE子刊——SCIENCE SIGNALING的研究:

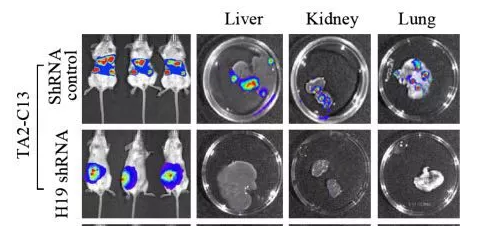
研究者以乳腺癌为例,揭示lncRNA在肿瘤转移中的重要作用。通过对转移能力强的细胞进行测序,研究者发现长非编码RNA H19显著的高表达。在敲除H19后,细胞的转移能力显著下降。
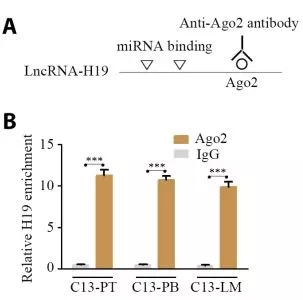
由于lncRNA被报道可以发挥ceRNA的功能,研究者通过(划重点!)以下三个实验证明H19可以吸附mir-200b/c和let7b.
1.AGO2 RIP实验,证明AGO2结合H19, mir-200b/c和let7c
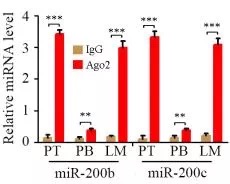
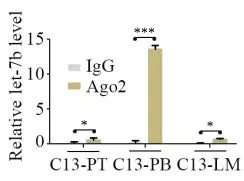
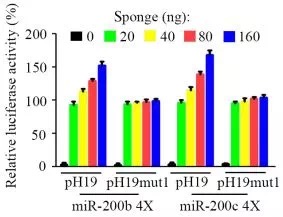
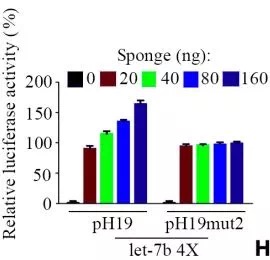
2.双荧光报告实验,证明H19可以吸附mir-200b/c和let7c。研究者细致地做了转染不同浓度H19的实验,发现荧光值确实随着H19的量变化。
3.敲低H19后,mir-200b/c和let7c的靶基因下调
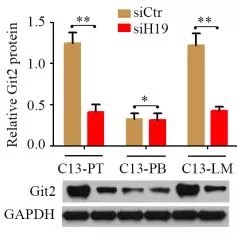
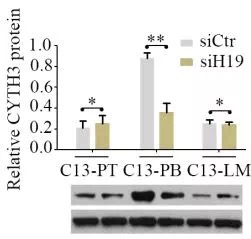
综上,研究者证明了H19通过吸附mir-200b/c和let7c,促进肿瘤转移的机制。
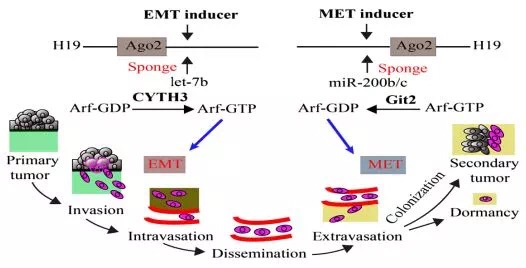
看着很简单对不对?其实该研究还有一个亮点——揭示了H19在肿瘤转移的不同阶段(EMT和MET),通过吸附不同的miRNA发挥作用的机制。总的来说,ceRNA的套路是比较简单的,想要做出新意,还需要在该ceRNA说明的问题上多下功夫。
1.Yonghao Yu, and Yiwen Chen,The EmergingFunction and Mechanism of ceRNAs in Cancer,Trends in Genetics,review, , April 2016, Vol. 32, No. 4;
2. M. Piwecka et al.,Science10.1126/science.aam8526 (2017);
3. Dong Xie,The lncRNA H19 mediatesbreast cancer cell plasticityduring EMT and MET plasticity bydifferentiallysponging miR-200b/c and let-7b,Science Signaling,10, eaak9557 (2017)。
转载:解螺旋·临床医生科研成长平台





可以问一下,如果做sponge的话,circRNA一定需要有AGO2结合位点吗?我找了这方面的综述,存在AGO2结合位点的话,能帮助circRNA起sponge作用,但是也不是必须的;另外也找到了,不含AGO2结合位点的、做sponge基因的circ,请问小编,有没有能推测circRNA的sponge功能的方法啊?(我知道的是可以利用,circinteractome数据库看circ有无AGO2结合位点,推测其能力)多谢多谢