EB病毒(Epstein-Barr virus,EBV)是疱疹病毒科嗜淋巴细胞病毒属的成员,基因组为DNA。EB病毒具有在体内外专一性地感染人类及某些灵长类B细胞的生物学特性。人是EB病毒感染的宿主,主要通过唾液传播。无症状感染多发生在幼儿,3~5岁幼儿90%以上曾感染EB病毒,90%以上的成人都有病毒抗体。
EB病毒是传染性单核细胞增多症的病原体,此外EB病毒与传染性单核细胞增多症、咽癌、儿童淋巴瘤的发生有密切相关性。其致病机制是EB病毒在口咽部上皮细胞内增殖,然后感染B淋巴细胞,这些细胞大量进入血液循环而造成全身性感染,并可长期潜伏在人体淋巴组织中。EBV感染可表现为增殖性感染和潜伏性感染。不同感染状态表达不同的抗原,增殖性感染期表达的抗原有EBV早期抗原、EBV衣壳蛋白和EBV膜抗原,潜伏感染期表达的抗原有EBV核抗原和潜伏膜蛋白。
本文亮点:
1. EBV编码的miRNA通过外泌体从感染细胞转移到非感染细胞中,具有调节肿瘤发生的功能;
2. EBV编码miRNA的产生将是用于将EBV+ DLBCL患者分成两组(预后好还是预后差)的优异诊断标记。
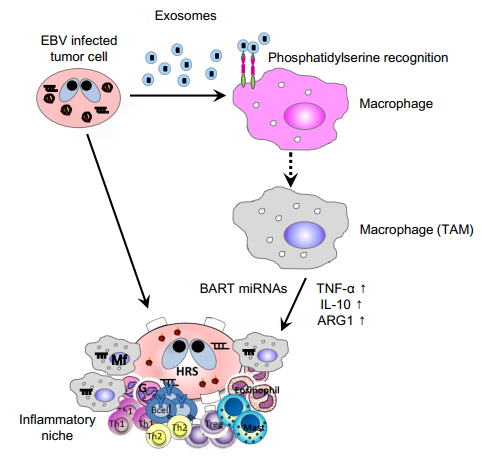
导读:在老年人中EBV病毒可引起各种疾病,包括B细胞淋巴瘤如霍奇金淋巴瘤(HL)和弥漫性大B细胞淋巴瘤(DLBCL),患有以上两种肿瘤病人中EBV阳性的预后比EBV阴性的差,所以需要建立一种专门治疗EBV+ B细胞淋巴瘤策略。Akata毒株最初是从Burkitt’s淋巴瘤中分离出来的。 B95-8毒株最初从传染性单核细胞增多症分离,并保持在狨猴淋巴母细胞系中。他们是两种完全不同的EBV毒株,B95-8毒株上BamHI片段A向右转录物(BART)区域基因组缺失是最显著的区别。在人源化小鼠模型中,两种EBV毒株(Akata和B95-8)形成不同的淋巴组织增生性疾病(LPD)的差异是明显的。研究中作者发现,EBV通过分泌外泌体反式作用于肿瘤中的未被感染的巨噬细胞并增强淋巴瘤的发展。此外,体内注射Akata来源的外泌体可能通过调节巨噬细胞表型来影响LPD严重性。据报道,从Akata-淋巴母细胞系(LCL)收集的外泌体含有EBV来源的非编码RNA,如BART miRNA和EBV编码的RNA(EBER)。作者聚焦于外泌体介导的BART miRNA的递送。体外BART miRNA可诱导以白细胞介素-10(IL-10),肿瘤坏死因子-α(TNF-α)和精氨酸酶1(Arginase-1)基因表达为特征的巨噬细胞的免疫调节表型,提示BART miRNA具有免疫调节作用。EBV编码的miRNA的表达水平与老年人弥漫大B细胞淋巴瘤患者的临床预后密切相关。这些结果提示BART miRNAs是调节淋巴增殖性疾病严重程度的因素之一,并且可作为EBV+ B细胞淋巴瘤的诊断标志物[1]。
1. 体内Akata和B95-8毒株可以造成不同程度的淋巴增生性疾病
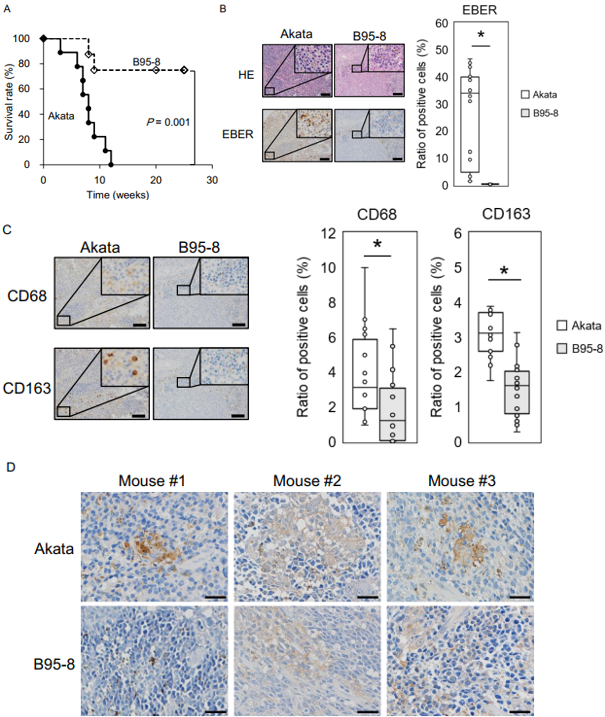
作者给NOD小鼠回输人造血干细胞建立人源化小鼠模型,静脉回输Akata组小鼠在12周后全部死亡,其脾脏有大量EBER+细胞浸润;而回输B95-8组小鼠存活率高达75%,没有出现体内病毒复制和体重减轻症状的淋巴增生性疾病(A, B)。免疫组化结果显示,Akata组小鼠脾脏中CD68+ 和CD163+ 细胞(M1促炎性和M2型抑炎性巨噬细胞marker)明显高于B95-8组小鼠的(C)。在肿瘤细胞中心区域,CD68+稀疏分布,而CD163+聚集分布。同时Akata组小鼠脾脏高表达IL-10(D),以上结果提示Akata毒株会诱导免疫抑制性微环境。
2. 人源化小鼠模型中EBV+淋巴瘤分泌的外泌体会造成严重的淋巴增生性疾病(LPD)
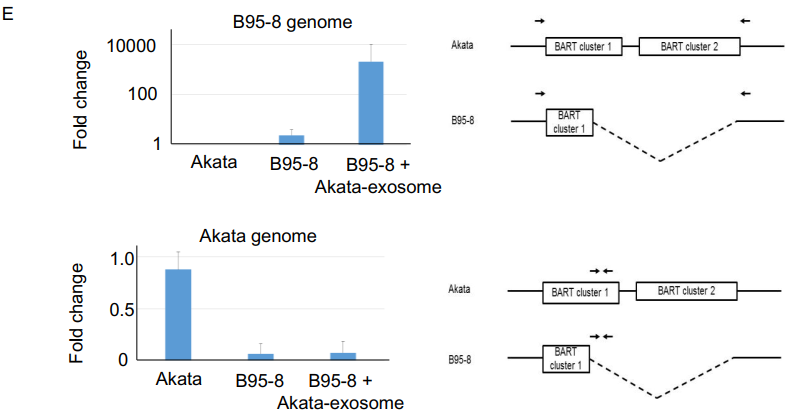
经典超离法获得Akata-exosome和B95-8-exosome,其电镜形态(A)。Akata和 B95-8感染人化小鼠8周后静脉回输 Akata-exosome和 B95-8-LCL-exosome后,Akata-exosome组小鼠的存活率明显下降(B),B95-8-exosome组小鼠存活率超过75%。但是当B95-8感染小鼠后回输Akata-exosome,H&E染色和免疫组化结果显示,脾脏中EBER+淋巴细胞明显增多,相当于Akata感染小鼠的情况(C),同时CD68+和CD163+细胞数目明显多于Akata感染小鼠组的(D)。作者为了排除外泌体提取过程中受到EBV病毒污染的情况,B95-8组和B95-8+Akata-exosome组只检测到高水平的B95基因组,没检测到Akata基因组,而Akata感染小鼠组只检测到高水平的Akata基因组(E)。E图右侧图为作者设计检测Akata和B95-8基因组的引物。以上结果提示Akata-exosome在人化小鼠中造成严重的LPD疾病,可能是因为脾脏中巨噬细胞浸润增加。

3. 人化小鼠模型中去除CD163+巨噬细胞会促进EBER+淋巴瘤细胞的清除
对Akata感染小鼠给“消除巨噬细胞”的药——氯膦酸盐脂质体5天后,CD68+巨噬细胞虽然有部分存留,但是CD163+巨噬细胞几乎全部消失,同时非常神奇的是EBER+淋巴瘤细胞也几乎被清除(在几个小鼠中完全消失)。以上结果提示巨噬细胞,特别是CD163+巨噬细胞对于EBV+淋巴瘤的发生发展很重要。

4. Akata-exosome通过磷脂酰丝氨酸(PS)介导“吃我”信号,从而被单核细胞摄取
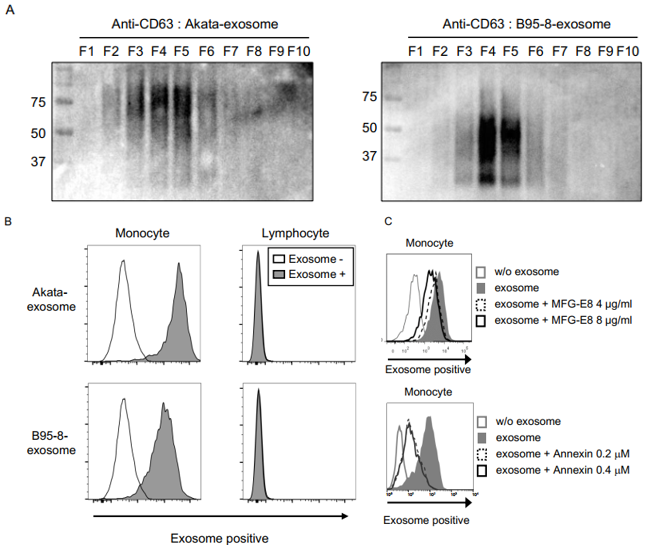
Akata-exosome是否会直接或间接影响巨噬细胞的表型?通过碘克沙醇密度梯度超速离心收集到的Akata-exosome和B95-8-exosome经WB分析两种来源外泌体的CD63糖基化大小分布不一样(A),提示两种毒株感染细胞内的糖基化机制不一样。随后PKH26红色荧光染料染色外泌体后,刺激人PBMCs 48h后,流式检测PBMCs胞内荧光的增加具有外泌体剂量依赖性和时间依赖性(B)。另外,只有用高剂量的染色Akata-exosome,而不是B95-8-exosome,刺激淋巴细胞6h,才能检测到细胞荧光,而且24h和48h后这种荧光就检测不到,提示高剂量外泌体只是短暂影响或者吸附在淋巴细胞,而不是像外泌体被单核细胞摄取一样被检测到, PBMCs中主要是单核细胞摄取外泌体。
外泌体通过什么机制被细胞摄取?利用人类重组牛奶脂肪球表皮生长因子8(MFG-E8)和annexin-V阻断外泌体PS结合后,单核细胞摄取到的带荧光外泌体明显减少,具有剂量依赖性(C),提示单核细胞摄取Akata-exosome主要是依赖于PS介导的“吃我”信号。
5. 外泌体刺激通过递送BART miRNA促使单核细胞表型转换为免疫调节表型
外泌体摄取对单核细胞会有什么影响?与B95-8-exosomes相比,Akata-exosomes被单核细胞摄取后,流式检测细胞表面CD69活化分子明显上调(A),提示这种外泌体具有调节炎症反应的功能。结合前人的研究(EBV+淋巴瘤分泌外泌体携带ncRNA调节免疫反应)发现,RT-qPCR检测发现B95-8-exosomes和Akata-exosomes内的EBER1基因表达无显著性差异,由于B95-8细胞基因组本来就缺失12kb BART基因座, 那BART miRNAs对于单核巨噬细胞表型是否有影响?
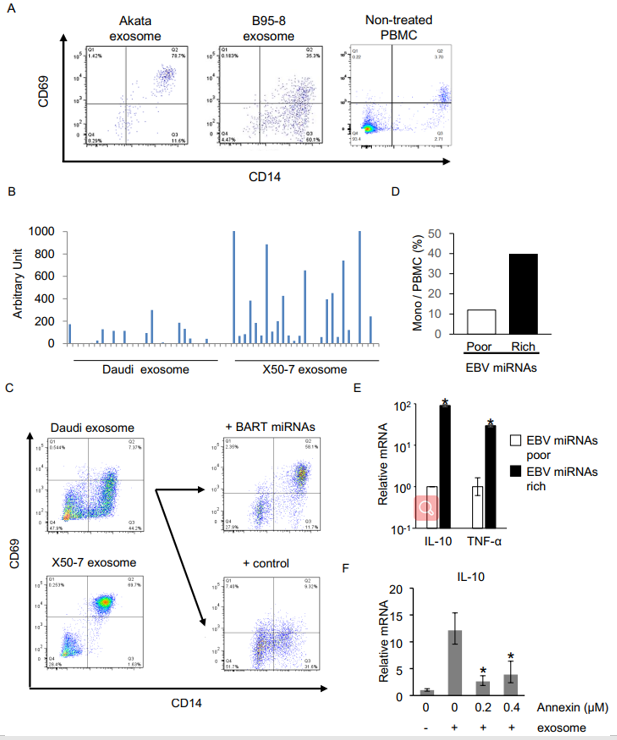
已有文献报道,两种Daudi(Burkitt’s淋巴瘤细胞)和LCL X50-7细胞的BART miRNAs表达水平有差异,RT-qPCR检测验证发现X50-7-exosomes (BART miRNA-rich)中的BART miRNAs表达水平明显高于Daudi-exosomes(BART miRNA-poor)的(B)。X50-7-exosomes能明显上调CD14+单核细胞中的CD69表达,而Daudi-exosomes不能,但是过表达BART miRNA的Daudi细胞分泌的外泌体可明显上调CD14+单核细胞中的CD69表达(C)。X50-7-exosomes刺激单核细胞后MONO/PBMCs升高(D),qPCR检测显示TNF-α、IL-10表达明显上调(E),而给予annexin V阻断外泌体摄取后明显抑制IL-10基因表达(F)。以上结果提示外泌体递送的BART miRNAs在诱导单核细胞发挥免疫调节功能(TNF-α和IL-10表达)中起重要作用。
6. BART miRNAs明显改变了人单核性白血病细胞THP-1的基因表达
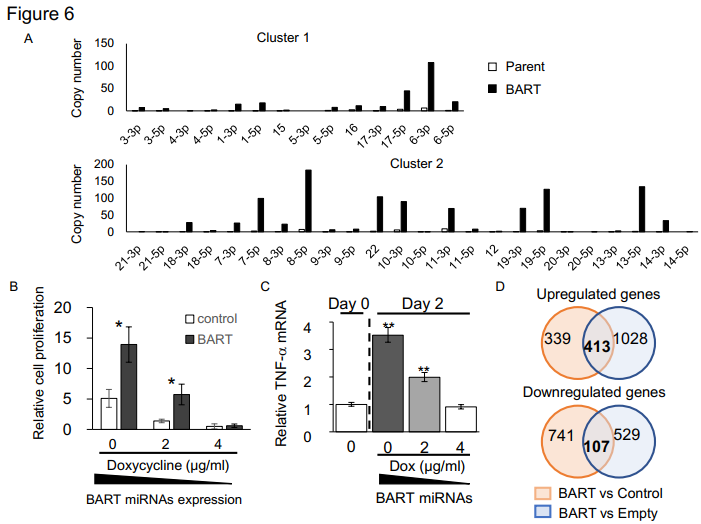
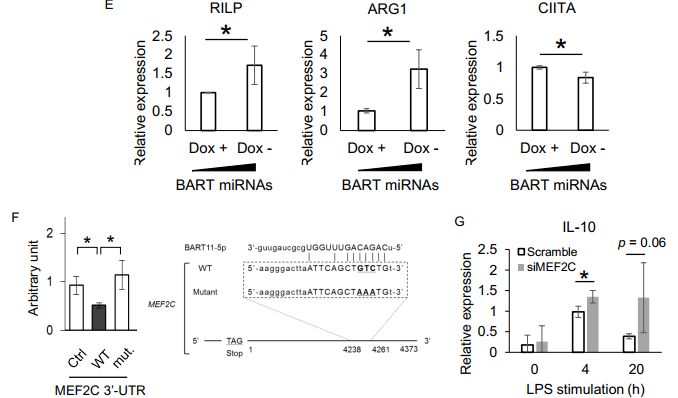
BART miRNAs如何改变单核细胞的表型?在THP-1细胞上采用一种Tet-Off系统—强力霉素诱导BART miRNAs表达下调(A),能剂量依赖性地促进细胞增殖和TNF-α表达上调(B, C)。基因芯片数据分析BART miRNAs过表达细胞中400个基因上调,100个基因下调(D)。RT-qPCR验证显示BART miRNAs过表达后,ARG1(TAM巨噬细胞的marker)、RILP(参与溶酶体成熟和转运的分子,是M2样巨噬细胞的特征之一)表达上调,CIITA(HLA-II反式转录活化因子,获得性免疫)表达下调(E)。同时In silico预测分析BART miRNAs下调靶基因是MEF2C 和 CD1c基因,通过荧光素酶报告基因验证其相互作用(F)。同时通过siRNA knockdown MEF2C实验验证,RT-qPCR检测IL-10表达上调(G),而TNF-α表达不受影响(调控机制不一样)。以上结果提示BART miRNAs能调控THP-1细胞的基因表达,进而调节免疫反应。
7. 淋巴瘤外泌体的BART miRNAs 与患有EBV+ DLBCL老年病人的临床预后密切相关
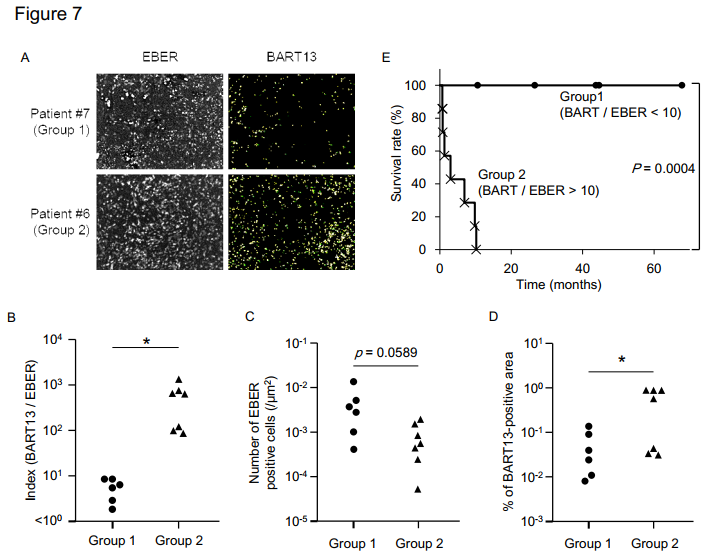
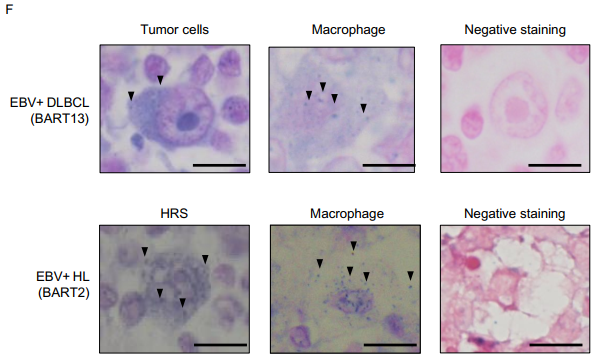
EBER 是检测EBV感染的marker,13位EBV+ DLBCL病人活检样本荧光原位杂交分析发现,BART13(其中一种BART miRNAs)在EBV+淋巴瘤病人中表达非常多(A)。BART/EBER(代表EBER+淋巴瘤细胞产生的BART13数量)比例可以分为两组group1(比例<10)和group2(比例>10),EBER+淋巴瘤细胞数目没差异,而group2产生BART13数量增加(B-D),导致病人存活率显著降低(E)。而且在EBV+DLBCL病人活检样本中的EBER+淋巴瘤细胞和一些巨噬细胞内检测到BART13表达; 在霍奇金淋巴瘤病人样本中的Hodgkin/Reed-Sternberg细胞和巨噬细胞内中检测到BART2(F),提示EBV+瘤细胞很有可能转移BART miRNAs到未被EBV感染的巨噬细胞,调节其功能。
总结:EBV+淋巴瘤细胞分泌的外泌体携带了各种BART miRNAs,通过其表面的PS被单核巨噬细胞摄取后,改变单核巨噬细胞内基因的表达,上调了TNF-α、IL-10、Arg1基因表达,促使巨噬细胞表型转变为免疫调节性表型,促进了淋巴瘤发展。该研究提示了临床上可使用生物活检检测BART/EBER,根据BART/EBER诊断病人的预后,也为未来临床治疗EBV+病人提供了很好的治疗靶点和诊断策略。
参考文献,1. Higuchi H, et al. Role of exosomes as a proinflammatory mediator in the development of EBV-associated lymphoma[J]. Blood. 2018. doi: 10.1182/blood-2017-07-794529. [Epub ahead of print](笔者下载了好久,下回来才发现是原稿,惊呆了)
通讯作者Ai Kotani是日本东海大学的副教授,主要研究方向是小RNA与白血病、淋巴瘤关系的,具体简历可以看http://www.pr.tokai.ac.jp/tuiist/english/tt/2010_koutani.html





来第一个抢占沙发评论吧!