神经调节蛋白1(neuregulin-1, NRG-1)是神经调节蛋白家族成员之一。NRG-1蛋白结构上含有表皮生长因子(epidermal growth factor, EGF)样的胞外结构域和高度保守的胞内结构域(intracellular domain, NRG-1-ICD)。NRG-1被基质金属蛋白酶水解后释放出具有生物活性的EGF胞外段;胞内段NRG-1-ICD则进入细胞核,通过与一些转录因子相互作用而调节基因表达;此外,NRG-1-ICD含有的LIM结构域还参与和胞浆蛋白的相互作用。许多研究表明,NRG-1在心血管生理及病理过程中都发挥重要作用。血小板源性生长因子BB(platelet-derived growth factor BB, PDGF-BB)能够刺激血管平滑肌细胞(VSMCs)去分化成合成型表型,使细胞增殖和迁移增加;而TGF-β1能够维持细胞分化呈收缩表型。在VSMCs中,NRG-1可抑制由PDGF-BB引起的细胞增殖和迁移。但是,TGF-β1诱导的VSMC分化是否需要NRG-1-ICD参与以及NRG-1-ICD如何调节VSMCs的功能目前尚无报道。
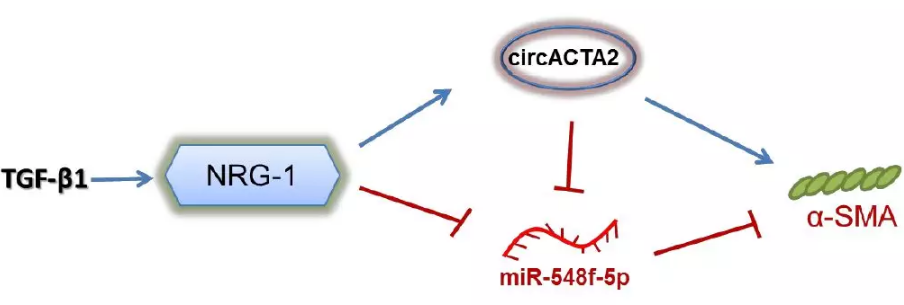
环状RNA(circular RNA, circRNA)是一种对真核基因表达具有调节功能的共价、闭合、单链RNA。circRNA可作为微小RNA(micro RNA,miRNA)的“海绵”竞争性结合胞内miRNA,阻断miRNA对其靶基因的抑制作用,从而上调miRNA靶基因的表达。除此以外,circRNA也可通过与RNA结合蛋白(RNA-binding protein, RBP)结合,或者与其他RNA通过碱基互补结合而对特定基因发挥调节作用。目前关于描述VSMC中的circRNA表达调控和生物学功能的信息很少。本研究基于以上基础,以TGF-β1作为VSMC分化的诱导因素,首次证明NRG-1-ICD诱导的circRNA——circACTA2,通过与miR-548f-5p相互作用,从而释放miR-548f-5p对α-SMA的抑制作用。
结果
1. TGF-β1诱导VSMCs产生NRG-1,其胞内结构域参与细胞骨架组织
NRG-1 在正常动脉组织和 VSMC 细胞中表达丰富,而在内膜增生状态下表达减少(图1A,B)。WB 结果显示 TGF-β1以时间依赖性的方式上调NRG-1蛋白表达(图1C)。TGF-β1 处理后的 VSMCs 上清中,NRG-1β(NRG-1 的可溶性生物活性形式)增加,但 PDGF-BB 不影响 NRG-1β 水平(图1D,Online Figure IIE)。结果表明 TGF-β1 不仅诱导 NRG-1 表达,而且促进其被蛋白水解酶切割成活性形式。
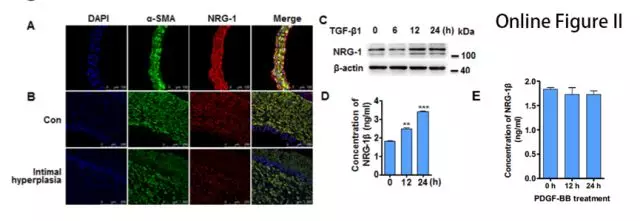
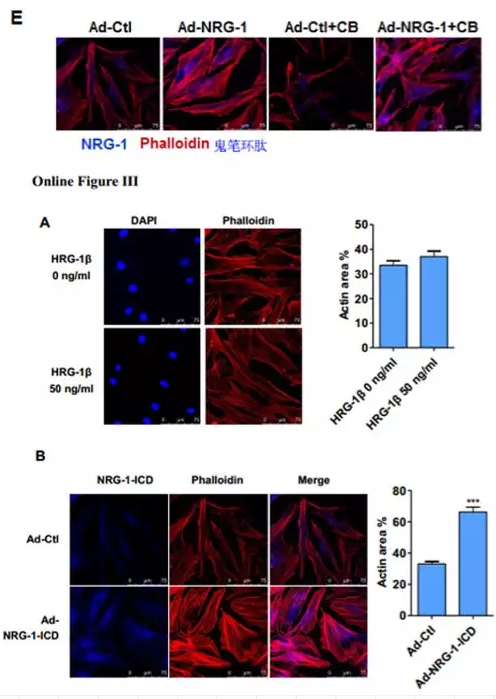
接下来,在HASMCs细胞中用腺病毒过表达NRG-1,结果发现NRG-1可以促进肌动蛋白丝(actin filaments, F-actin)募集成肌动蛋白束,且能抵抗细胞松弛素(CB)诱导的解聚(图1E),表明NRG-1参与F-actin的形成并稳定其结构。作者进一步探究发现用NRG-1β处理细胞不影响肌动蛋白细胞骨架(Online Figure IIIA),但是过表达NRG-1-ICD细胞骨架则出现束状排列(Online Figure IIIB),表明NRG-1通过其ICD域介导细胞骨架组织。
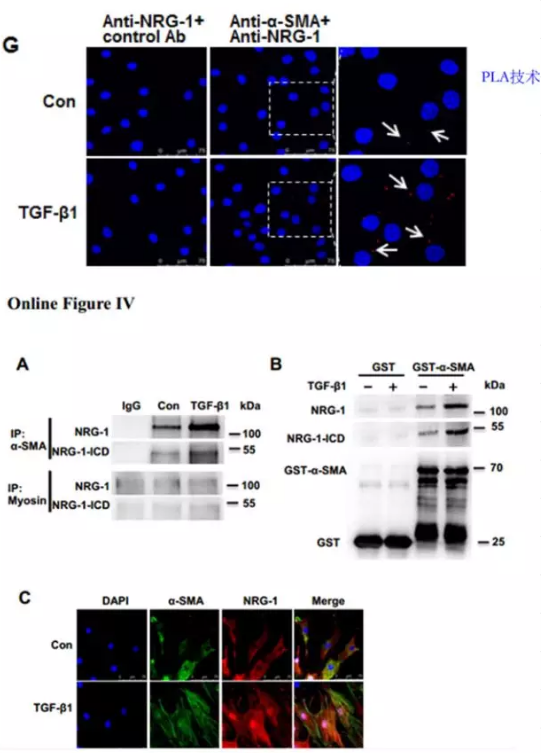
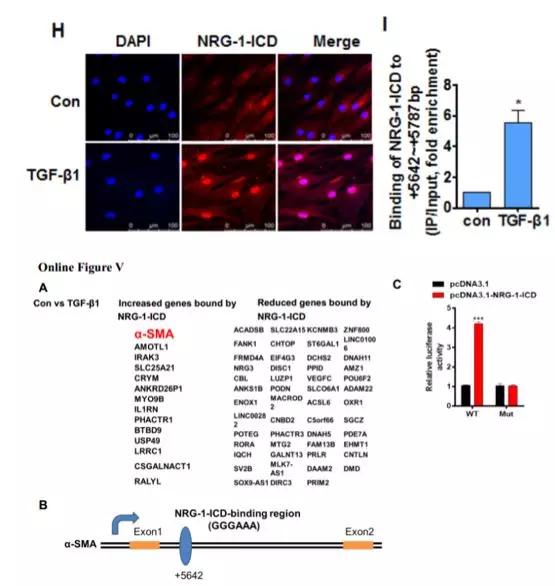
进一步探究NRG-1-ICD参与细胞骨架的组织是否依赖于NRG-1-ICD与α-SMA的相互作用。免疫荧光结果显示,TGF-β1 刺激HASMC 细胞后NRG-1-ICD 和 α-SMA的表达水平均上升,且共定位(Online Figure IVC)。免疫共沉淀,GST pull-down ,邻位连接技术(PLA)等实验结果进一步证实, TGF-β1 促进了NRG-1/NRG-1-ICD 和 α-SMA的结合(Online Figure IVA,IVB,图 1G)。这些发现表明 TGF-β1 可以直接促进NRG-1-ICD 与α-SMA 相互作用从而参与细胞骨架组织。
2. NRG-1-ICD通过与α-SMA基因的第一内含子结合而上调α-SMA表达
在TGF-β1处理后的细胞中观察到NRG-1-ICD发生明显的核易位(图1H)。结合染色质免疫沉淀测序(ChIP-seq),有65个与NRG-1-ICD差异结合的基因,α-SMA基因(也称为ACTA2)属于14个上调的基因之一(Online Figure VA)。对ChIP-Seq结果进行验证,结果发现TGF-β1促进α-SMA基因内含子区与NRG-1-ICD的结合(图1I)。构建NRG-1-ICD-binding site和NRG-1-ICD-binding site mut荧光素酶报告基因载体,与NRG-1-ICD表达质粒共转染后,观察到野生型NRG-1-ICD-binding site活性明显升高(Online Figure VC)。这些结果表明,NRG-1-ICD与α-SMA基因第一内含子区+5642 bp/+5787 bp结合(Online Figure VB)。NRG-1-ICD的过表达和敲低实验显示,NRG-1-ICD增加TGF-β1诱导后α-SMA的表达(图1J)。过表达鼠源NRG-1-ICD可以回复人VSMC敲降NRG-1-ICD后的表型(Online Figure VG),进一步明确 NRG-1-ICD通过与α-SMA基因的第一内含子结合而上调α-SMA表达。
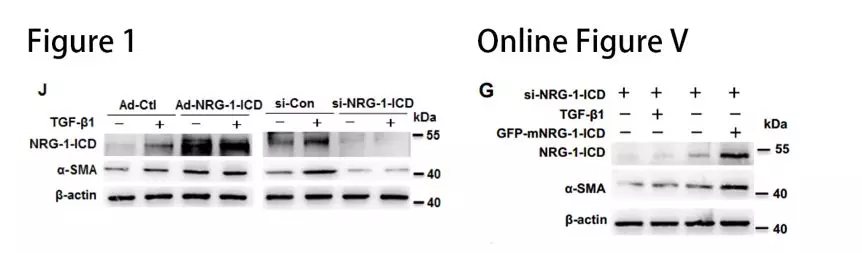
NRG-1-ICD诱导新的circRNA,即circACTA2的形成:作者查阅数据库,发现α-SMA基因座可以产生4个α-SMA circRNA,而NRG-1-ICD 过表达不影响α-SMA mRNA 水平且能与α-SMA基因的第一内含子结合,推测NRG-1-ICD可能通过诱导circRNA生成上调α-SMA表达。验证发现扩增不出已知的4个α-SMA circRNA,但是他们发现一条全新的长度为730bp的circACTA2。
作者设计针对circACTA2的引物,以cDNA和基因组DNA为模板进行RT-PCR。结果显示, cDNA模板可以扩增出circACTA2,而gDNA模板则不能扩增出此片段(Online Figure VIA)。RNase R降解线性RNA后,α-SMA mRNA水平显著降低,对circACTA2的影响较小(Online FigureVIB)。northern印迹进一步证明了circACTA2来源于α-SMA基因的5号外显子至9号外显子的环化(图2A)。这些结果鉴定circACTA2为一个新的环状RNA
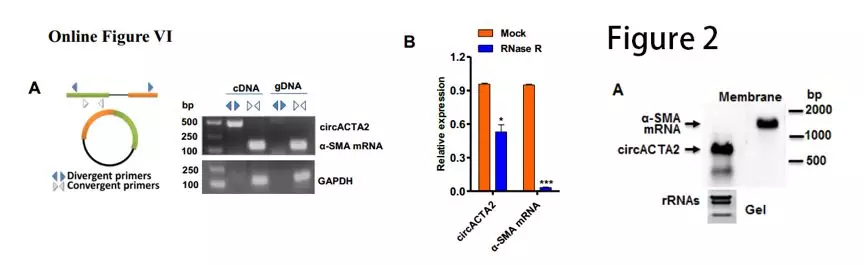
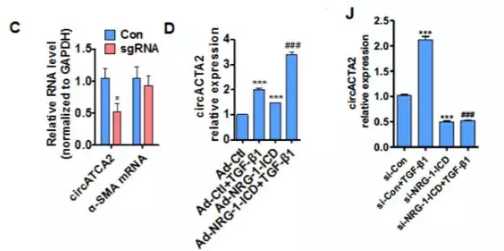
为了研究NRG-1-ICD是否可以影响circACTA2的形成:研究者用CRISPR interference(CRISPRi)技术,合成一段与NRG-1-ICD结合位点互补的单链gRNA,它通过介导 Cas9 酶切割α-SMA 基因第一内含子而阻断转录。结果显示,切断NRG-1-ICD结合位点后,circACTA2表达降低,而α-SMA mRNA没有变化(图2C)。TGF-β1和NRG-1-ICD单独或联合过表达增加circACTA2的表达,而NRG-1-ICD敲降消除了TGF-β诱导的circACTA2上调(图2D, Online Figure VIJ)。这些研究结果表明NRG-1-ICD通过与α-SMA基因的第一个内含子结合而介导circACTA2形成。
3. NRG-1-ICD通过募集IKZF1至α-SMA基因的第一内含子,诱导circACTA2形成
研究者通过生物素标记pull-down实验来寻找HASMC中与NRG-1-ICD结合序列相互作用的蛋白质,转录因子Ikzf1(Ikaros)、PHB2和ASCC3被募集。免疫共沉淀、两步法ChIP和PLA等实验显示,在TGF-β1处理的细胞中Ikzf1与NRG-1-ICD相互作用,TGF-β1增加了它们的相互作用(图2E-G,Online Figure VIIA)。这些结果表明NRG-1-ICD与Ikzf1形成稳定的复合物。
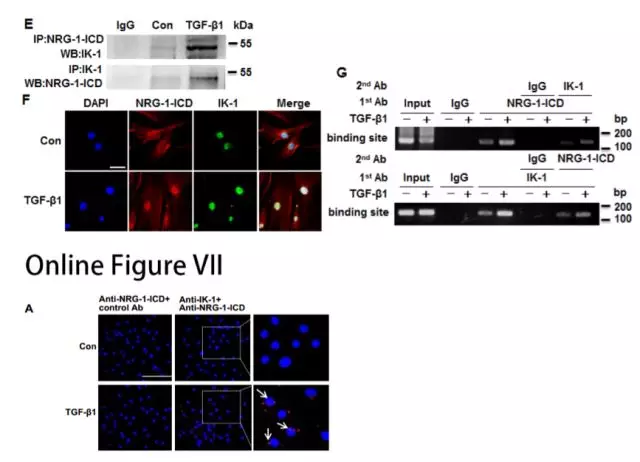
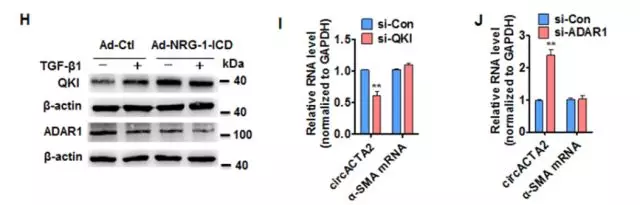
为了研究RNA结合蛋白Quaking(QKI)和RNA编辑酶ADAR1是否参与TGF-β诱导的circACTA2形成,研究者发现TGF-β1/NRG-1-ICD影响了QKI/ADAR1的表达,说明二者可能参与NRG-1-ICD诱导的circACTA2形成。(图2H)。QKI或ADAR1敲降后,circACTA2形成分别减少或增加,但α-SMA mRNA水平未受影响(图2I和2J)。这些数据表明QKI和ADARI影响NRG-1-ICD诱导的circACTA2形成。
4.circACTA2通过减少miR-548f-5p来上调α-SMA
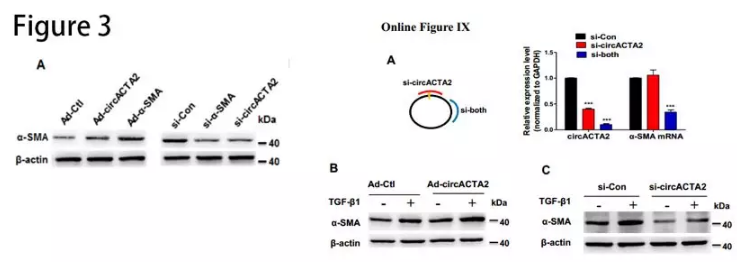
为了确定α-SMA的表达和circACTA2之间的关系,我们设计两个siRNA,一个特异性敲低circACTA2(si-circACTA2),另一个是同时敲低环状和线状ACTA2(si-both)。结果发现,si-circACTA2不影响α-SMA mRNA水平;si-both时,会使circACTA2和α-SMA mRNA的水平均下降(Online Figure IXA)。在HASMC中,过表达或敲除circACTA2显著影响了α-SMA蛋白的表达(图3A)。表明circACTA2在TGF-β1/ NRG-1-ICD诱导的α-SMA表达中起重要作用,且circACTA2可能通过转录后水平调节α-SMA表达。
circACTA2与miR-548f-5p有相互作用:RNAhybrid和miRanda-based预测circACTA2能与miR-548f-5p互补结合。萤光素酶测定表明miR-548f-5p mimic显着降低由野生型circACTA2序列介导的萤光素酶活性(Online Figure IXE)。生物素标记的pull-down实验发现,二者相互富集(图3B和3C)。RNA原位杂交的结果发现circACTA2与miR-548f-5p共定位(图3D)。在内膜增生的肾动脉中,miR-548f-5p水平显着增加(图3E),而circACTA2表达及其与miR-548f-5p的相互作用在内膜增生的动脉中减少(图3F和3G)。人circACTA2过表达不能减少小鼠股动脉损伤引起的内膜增生(Online Figure XA and XB),可能由于circACTA2具有物种特异性。
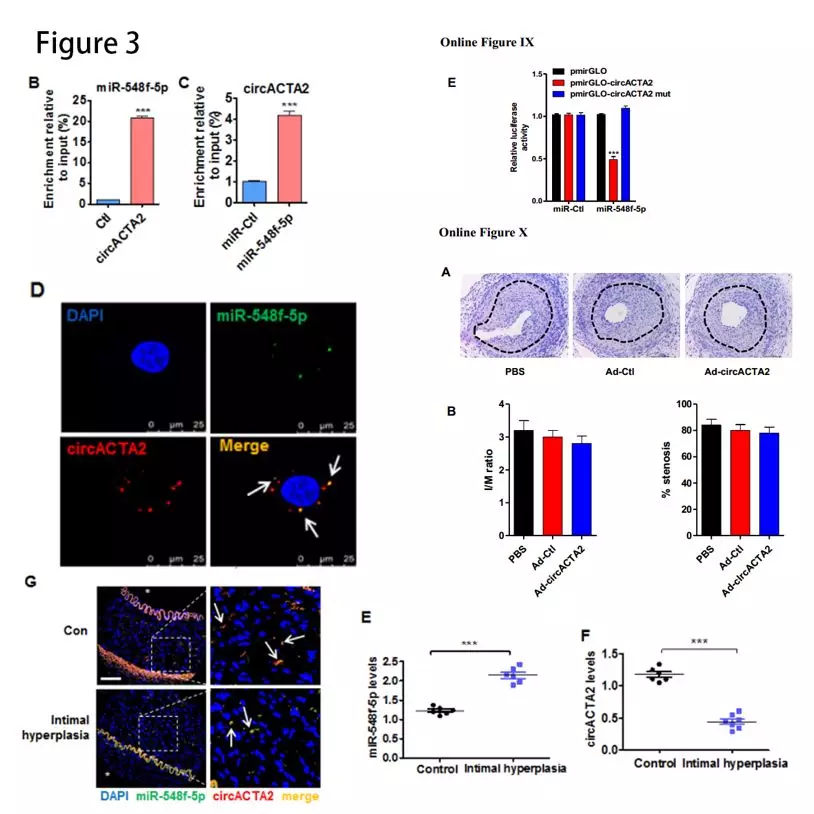
α-SMA是miR-548f-5p靶基因:人α-SMA 3′-UTR含有miR-548f-5p-结合位点。萤光素酶测定证实了miR-548f-5p与α-SMA 3′-UTR的结合(图3H)。miR-548f-5p mimic和anti-miR-548f-5p降低或增加α-SMA蛋白表达(图3I)。TGF-β1刺激和 NRG-1-ICD 过表达都可以使 miR-548f-5p 的表达水平降低,二者联合时降低更为显著(图3J)。这些结果表明,circ ACTA2 可以作为分子“海绵”吸附 miR-548f-5p。
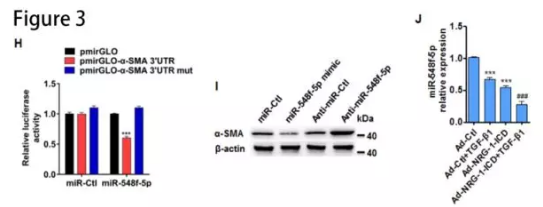
5. NRG-1-ICD / circACTA2 / miR-548f-5p轴调节HASMC收缩
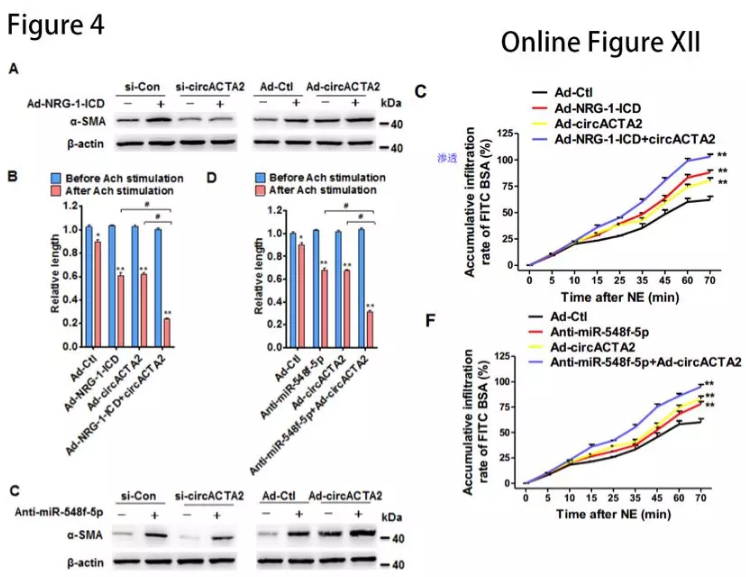
si-circACTA2显着降低NRG-1-ICD过表达诱导的α-SMA表达,反之亦然(图4A)。miR-548f-5p沉默或circACTA2表达的变化影响α-SMA表达(图4C)故circACTA2和miR-548f-5p是NRG-1-ICD诱导α-SMA表达的关键介质。
过表达circACTA2或NRG-1-ICD、以及沉默miR-548f-5p可以增加乙酰胆碱(Ach)或去甲肾上腺素(NE)诱导的HASMC收缩(图4B和4D,Online Figure XIIC和XIIF)。结果表明circACTA2作为miR-548f-5p的分子海绵促进α-SMA表达,影响细胞收缩。
参考文献:Sun Y, Yang Z, Zheng B, et al. A Novel Regulatory Mechanism of Smooth Muscle α-actin Expression by NRG-1/circACTA2/miR-548f-5p Axis[J]. Circulation Research, 2017, 121(6):CIRCRESAHA.117.311441.





来第一个抢占沙发评论吧!