|
A novel plasma circular RNA circFARSA is a potential biomarker for non-small cell lung cancer
血浆circFARSA或可作为非小细胞肺癌分子标志物
期刊:Cancer Medicine 影响因子:3.362
发表单位:南京医科大学
1 摘要
越来越多的证据表明circRNAs与癌症的发展密切相关。本研究的目的是评估circRNAs是否可以作为non-small cell lung cancer (NSCLC)新的分子标志物。我们使用RNAseq技术与qPCR的方法研究cancer相关的circRNAs。对肺癌circRNAs进行生物信息学和功能分析以揭示其生物学影响。RNAseq共鉴定到5471个circRNAs,其中185个在癌与癌旁组织中有差异表达。来自FARSA基因5-7外显子的环状RNA,命名为circFARSA,在癌组织中上调(P = 0.016),并在病人的血浆高丰度表达(P < 0.001)。A549细胞系过表达circFARSA,可以显著促销细胞迁移和侵袭。生信分析显示circFARSA或可海绵吸附miR-330-5p 和 miR-326,进而缓解对癌基因脂肪酸合酶的抑制作用。简单来说,本研究第一次揭示了NSCLC circRNA表达谱,并证明血浆circFARSA或可作为恶性肿瘤非侵入性的分子标志物。
2 材料方法
1 研究种群和样品收集
本研究获得南京医科大学伦理委员会的批准,并遵从Helsinki声明。实验分为两个阶段(Fig. S1)。高通量筛选,南京医科大学附属肿瘤医院收集10对非小细胞肺癌癌组织和癌旁组织,时间是2014.10-2015.12 (Table S1)。组织标本保存在RNAlater中,HE切片染色确认是代表性样品。验证时,招募50个非小细胞肺癌病人,并收集其血浆。排除有过其他癌,转移癌,或者接受过化疗放疗的。收集同期50个健康体检者的血浆。对照组没有癌,并依据年龄,性别与病人组(±5 years)进行配对。获得同意后,获取参与者相关信息如年龄,性别,抽烟情况等。
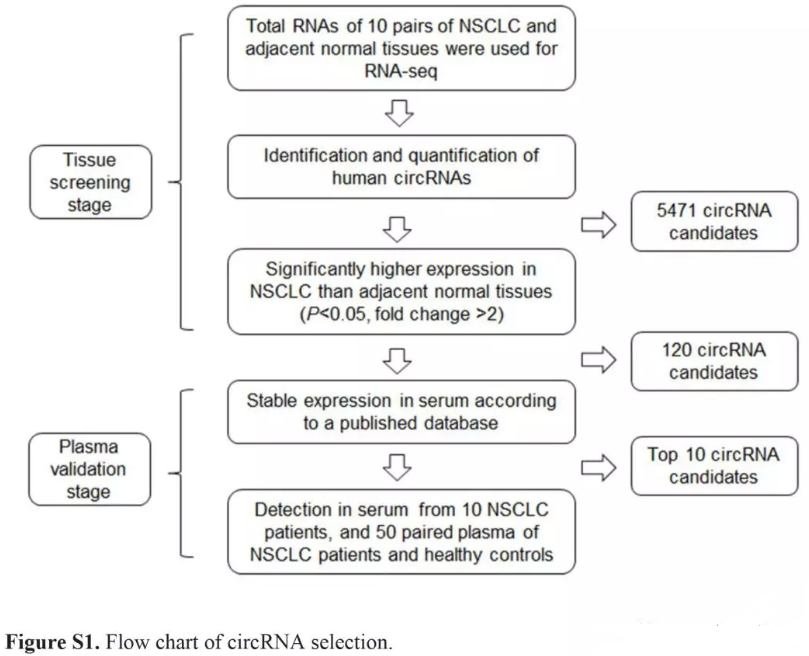

2 RNAseq及circRNA鉴定
RNeasy Mini Kit(Qiagen, Hilden, Germany)提取组织total RNA,Agilent 2100 Bioanalyzer system (Agilent Biotechnologies, Palo Alto, CA)评估质量。RNA Integrity Number ≥7.5可用于后续文库构建实验。去除rRNA, 而后使用TruSeq RNA Sample Prep Kit (Illumina, San Diego, CA)按照RNA片段化,随机引物cDNA合成,连接接头,PCR扩增流程进行。纯化后的cDNA文库Illumina HiSeq1500 platform上机测序,模式PE150.
CASAVA v1.8.2将BCL files转换为FASTQ格式,Trimmomatic version 0.32.43去除接头和低质量reads,使用参数为(ILLUMINACLIP: adapter.fa:2:30:10 LEADING:3 TRAILING:3 SLIDINGWINDOW:4:15MINLEN:20)。CIRCexplorer v 1.1.10流程用于鉴定和定量circRNAs,参数默认。至少含有两个back-spliced reads支持时方可确定为有效的circRNAs。剪接位点之间所有的reads作为表达量的丰度,用于计算circRNAs表达量。
3 血浆RNA提取和cDNA合成
TRIzol LS Reagent (Invitrogen, Carlsbad, CA) and RNeasy Plus Mini Kit (Qiagen)提取total RNA。为了设置内参,将100ng人工合成线虫totalRNA加入到血浆样品(200ul)中, 然后进行RNA提取。NanoDrop ND-2000 (Thermo Fisher Scientific, Wilmington, DE)检测RNA的纯度和密度。琼脂糖凝胶电泳检测RNA的完整性。random primers (PrimeScript RT Master Mix, Takara, Japan)合成模板cDNA。
4 qPCR分析
SYBR Premix Ex Taq™ II (Taraka, Japan) on ABI 7900 system进行qPCR,Cel-circRNA9 (cel_9)在线虫中高丰度表达,用于内参。cel_9 的发散引物为5′-TTGCAGCTCTCATAGAAGGAACCG-3′(sense) and 5′-GTTTCAGCCGAGACTAGACTTTGAGC-3′(antisense);而circFARSA的发散引物为5-GCTCCTTCTGGAACTTTGAC-3′(sense) and 5′-TTGCTCACCCAGTAGGTCTT-3′(antisense)。PCR产物进一步用Sanger测序检测成环位点。2−ΔΔCt计算circRNAs相对表达量。三个独立实验重复三次保证实验的可靠性。
5 质粒构建
SH-SY5Y细胞编码circFARSA的cDNA用以下引物进行扩增5′-CGGAATTCTGAAATATGCTATCTTACAGGACTCTGAAGACCTACTGGGTGAG-3′and 5′-CGGGATCCTCAAGAAAAAATATATTCACCTCGAAGGAAGAAGGTGTCGTGCT-3′。目标区域长度394bp,序列包含EcoR Isite,splice acceptor AG, circFARSA sequence, splice donor GT, and Bam HI site。EcoR I and Bam HI酶消化后,将片段克隆至pLCDH-ciR vector,对转录本进行环化。Sanger sequencing and qRT-PCR验证构建的质粒。
6 细胞增殖,迁移和侵袭实验
人类肺癌细胞系,A549购买于ATCC (American Type Culture Collection),通过short tandem repeat (STR)确认。CCK-8 kit (Doindo, Japan)试剂盒进行增殖实验。在0, 12, 24, 36, 48, and 72 h,加入CCK-8试剂,37℃孵育2h。microplate reader (BioTek, Winooski, VT)测量450nm处峰值。使用Costar Transwell plates (Coring, NY)按照之前描述的方法进行细胞迁移和侵袭实验。所有实验均独立重复三次。
7 生信分析
将circRNA序列作为种子,使用Circular RNA Interactome(基于TargetScan算法)预测circRNA-miRNA关系。而且,DIANA-TarBas ev.7.0构建miRNA-mRNA关系并进行KEGG分析,数据库来源于几百个文献实验验证的数据,包括超过150个CLIP-Sep库。Cytoscape software (http://www.cytoscape.org/)构建circRNA–miRNA–mRNA关系。
于TCGA data portal (https://portal.gdc.cancer.gov/)下载488 LUAD病人(包含57对癌与癌旁配对样品),489 LUSC病人(包含50个癌与癌旁配对样品)RNAseq数据(level 3)。
网页版Kaplan–Meier plotter,包含许多芯片数据,分析FASN预后值。Jetset scoring鉴定最优芯片探针。
8 统计分析
GraphPad Prism 6(GraphPad Software, San Diego, CA) and R software version3.3.0 (Free Software Foundation’s GNU project)进行统计分析。DESeq2鉴定RNAseq差异表达的circRNAs。TreeView 软件对差异表达显著的 circRNA进行聚类分析。计算Pearson相关性评估了组织与血浆circRNAs关系。血浆中差异表达circRNAs使用log转换,并用paired t-tests评估,P < 0.05认为有统计学意义,另所有检验都是双尾的。
3 结果
1鉴定差异表达circRNA表达谱
RNAseq在10个样品中共鉴定到5371个circRNAs。火山图展示癌与癌旁样品差异表达的circRNAs (Fig. 1A)。185 circRNAs有差异表达(P < 0.05),120个上调,65个下调 。tableS2是上下调top10 circRNAs。circRNAs在染色体的分布图如Figure 1B。聚类热图展示差异表达的circRNAs表达谱(Fig. 1C)。数据显示非小细胞肺癌癌与癌旁中circRNAs的表达谱是不同的。
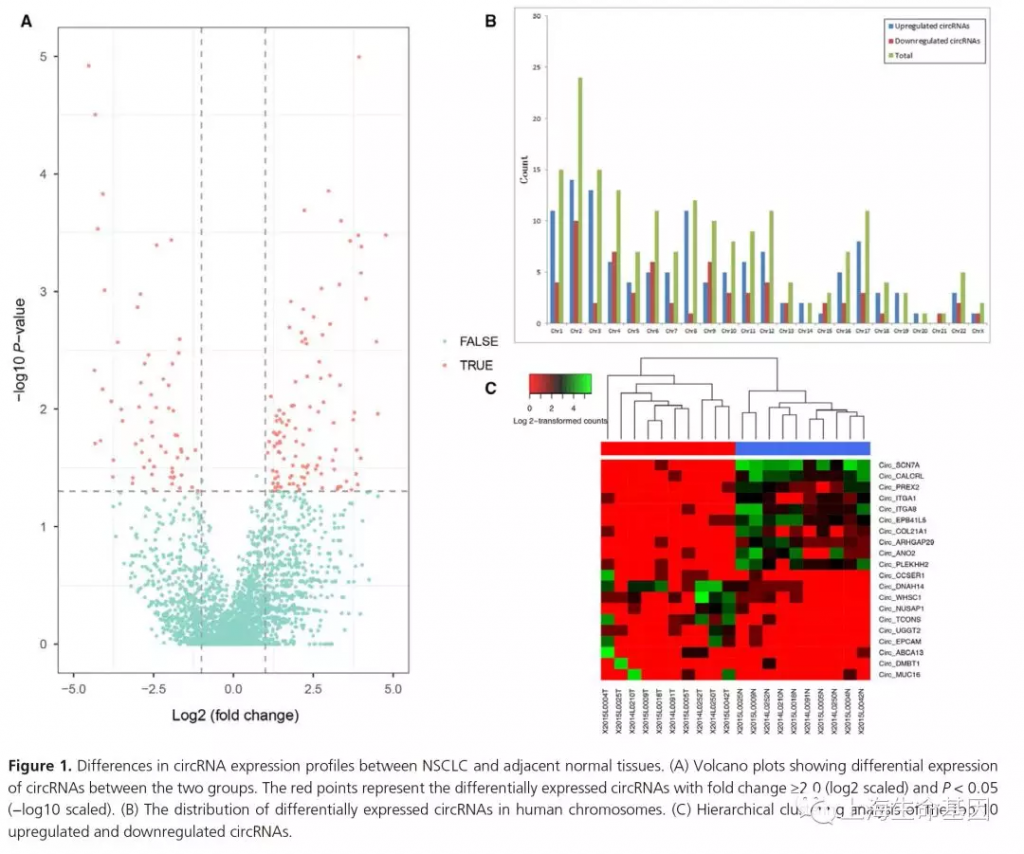

2 10个NSCLC病人血浆检测候选circRNAs
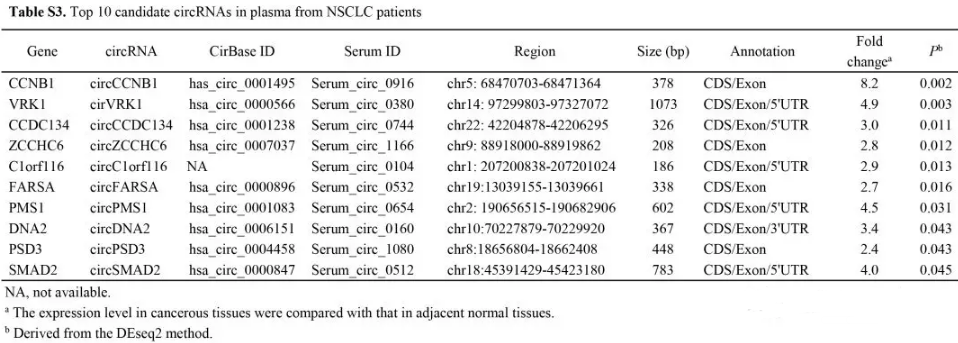
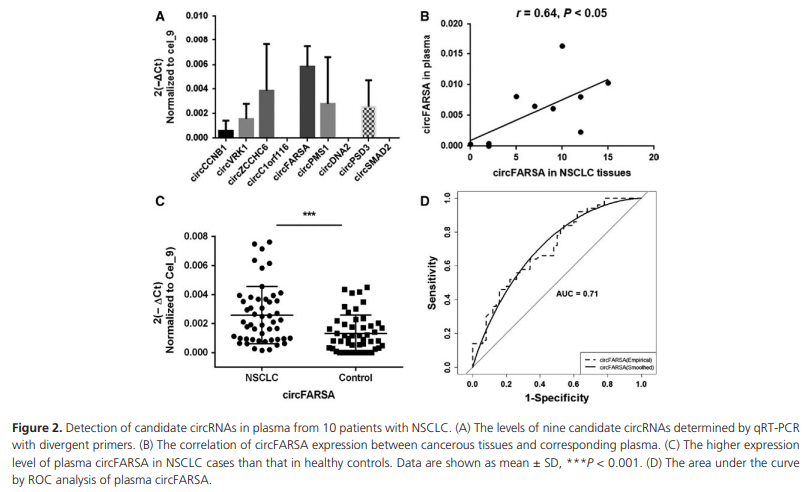
为了在血浆中更好的找到合适的circRNAs,我们结合已经发表的血清circRNAs表达谱数据,及我们发现上调的circRNAs数据。table S3列出前10个可以在血清中鉴定到的和上调的circRNAs。我们对这10个circRNAs在10个病人血浆中做了qPCR检测。其中circCCDC134没有找到合适的引物,其他9个均有检测到。circFARSA丰度最高。circFARSA在血浆与组织中表达量是相关的(r = 0.64, P = 0.047) (Fig. 2B)。

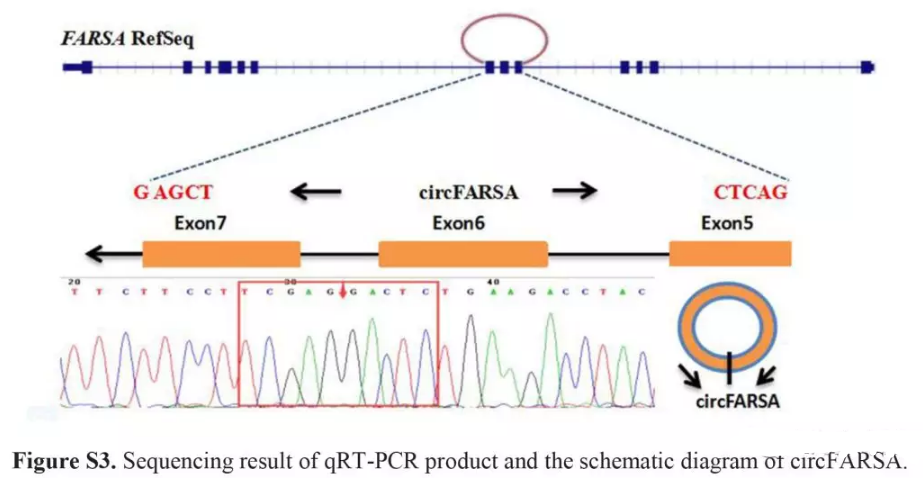
这是第一次对circFARSA设计发散引物,线虫cel_9作为内参,没有引物二聚体或特异性性扩增amplification (Fig. S2)。通过扩增circFARSA产物测序,我们确信序列与circBase的序列是一致的(http://www.circbase.org) (Fig. S3)。
3 NSCLC病人血浆circFARSA上调表达
qPCR验证circFARSA在50个NSCLC病人血浆和正常人血浆中的表达量。结果显示circFARSA在病人血浆中的表达量更高(P < 0.001)。我们也检测了血浆FARSA的mRNA的表达量,发现表达丰度太低而没有检测到。
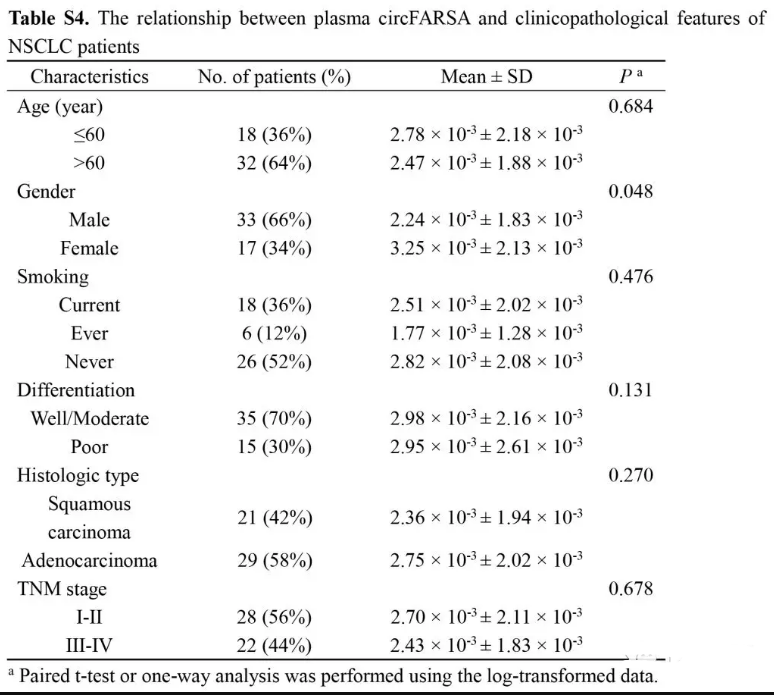
我们进一步分析血浆circFARSA表达量与病人临床特征的关系(Table S4)。除了与性别(P = 0.048)外,其他特征均没有显著的统计关系。
绘制ROC曲线(Fig. 2D)以评估circFARSA在NSCLC病人与健康人之间的诊断价值。ROC曲线以下区域面积为0.71。
4 circFARSA表型功能
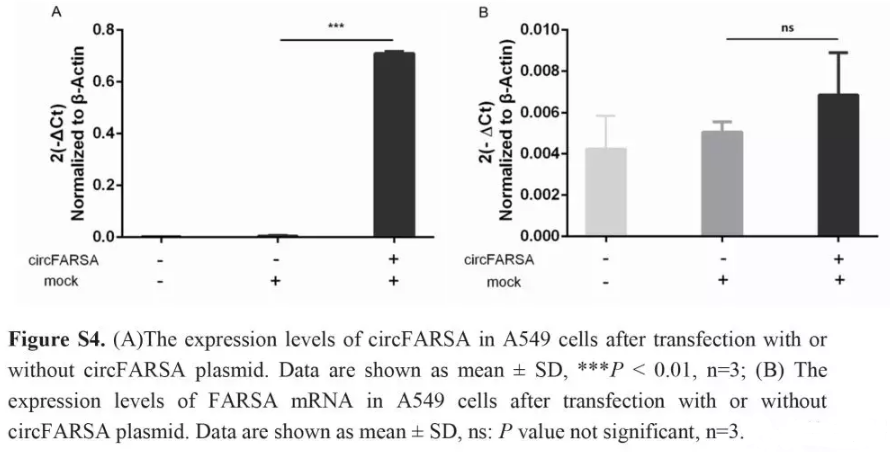
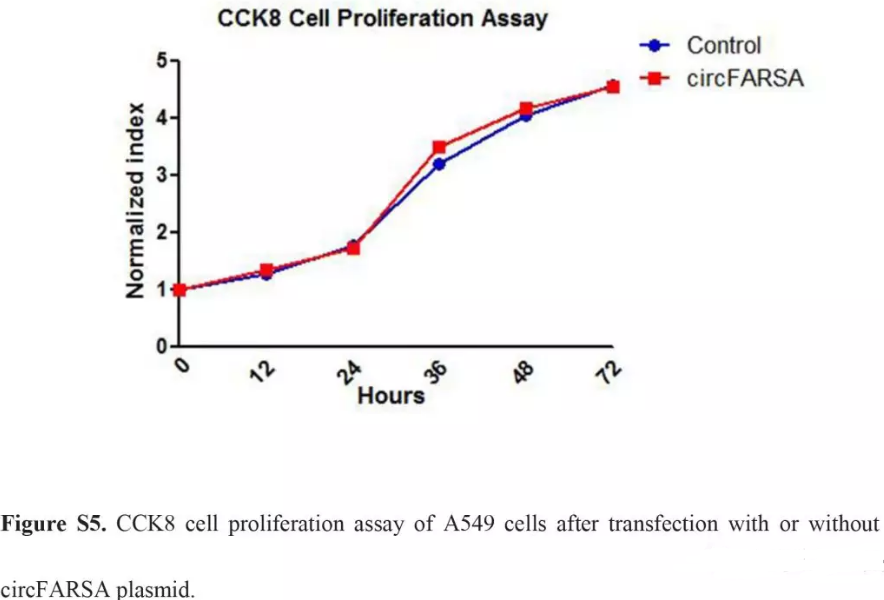
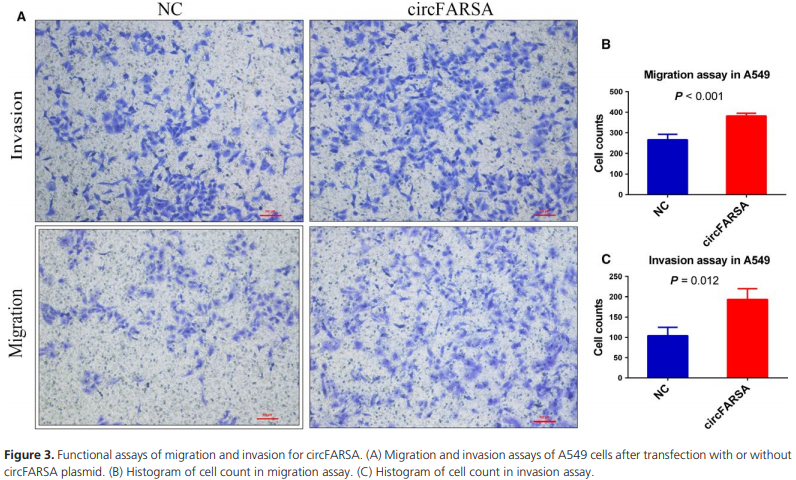
转染A549细胞,进行circFARSA过表达并用qPCR验证(Fig. S4A)。相比于空载体,circFARSA质粒细胞增殖的能力没有增强(Fig. S5),而迁移和侵袭能力增强(Fig. 3)。为了排除FARSA mRNA对于细胞迁移和侵袭的干扰。我们检测了circFARSA质粒加入前加入后FARSA mRNA的表达量,发现并没有显著变化(Fig. S4B)。
5 circFARSA调控的miRNA–mRNA通路
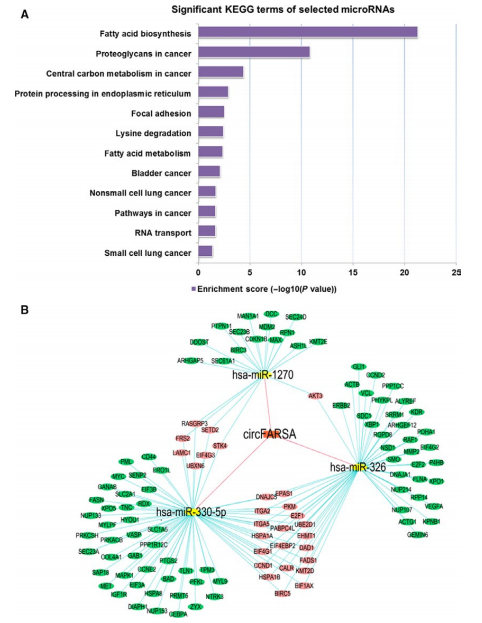
使用Circular RNA Interactome工具,我们得到了circFARSA结合的前5个miRNA:miR-330-5p, miR-326, miR-1178-3p, miR-620, and miR-1270,依据KEGG分析,得到12个通路,fatty acid biosynthesis通路是最显著的一个(Fig. 4A)。Cytoscape构建circRNA–microRNA–mRNA关系,发现miR-330-5p and miR-326有着最大的关系网(Fig. 4B)。
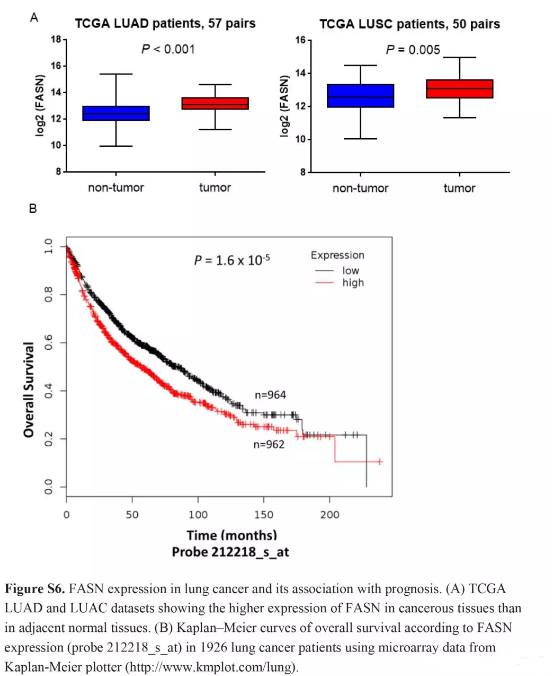
依据TarBase中HITS-CLIP实验,miR-330-5p and miR-326均能直接与fatty acid synthase (FASN)结合,该基因是各种癌中是一个癌基因。TCGA数据库,FASN在肺腺癌(n = 57, P < 0.001)和鳞状癌(n = 50, P = 0.005)中均高表达(Fig. S6A)。芯片数据Kaplan–Meier plotter (n = 1926)分析了FASN与预后的关系(HR = 1.81, 95% CI: 1.47–2.21, adjusted for clinical stage) (Fig. S6B)。
4 讨论
本研究,我们对NSCLC病人样品使用RNAseq技术发现了120个上调的circRNA,和65个下调的circRNAs。为了更好的在血浆中得到候选的circRNAs,我们整合已经发表的血清circRNAs表达谱数据及我们的数据。我们发现在血清可检测到的9个circRNAs中,circFARSA的表达丰度是最高的,而且,相比对照,NSCLC病人血浆circFARSA的表达量更高。ROC曲线下方值是0.71,显示血浆circFARSA或可作为NSCLC分子标志物。
近期研究表明有些 circRNAs在唾液,血清/血浆,血液中的表达是丰富而且稳定的。一个有趣的可能性是circRNAs通过一些载体比如外泌体分泌到胞外区间,这是病灶组织主动或被动的一种释放。Li et al.发现外泌体circRNAs能够区分结肠直肠癌病人和健康人。本研究,我们发现NSCLC病人组织样品与血浆样品circFARSA表达量有相关性。相比于外泌体提取的circRNAs中circFARSA表达量,我们发现血浆中的表达量更高。我们推断可能是其他的方式将circFARSA释放到血液中。
有报道称circRNAs具有海绵吸附miRNA作用,并可以调控miRNA靶基因的表达。比如CDR1as可以结合miR-7并下调一系列癌基因比如EGFR的表达。circHIPK3可以结合多个miRNAs,包括著名的肿瘤抑制因子miR-124。本研究,我们发现过表达circFARSA可以促进细胞迁移和侵袭。生信分析发现circFARSA具有许多miRNAs保守结合位点,比如miR-330-5p, miR-326, miR-1178-3p, miR-620, and miR-1270。这些miRNAs存在于一些癌相关的通路,包括脂肪酸合成,这在细胞的增殖和代谢中是极为重要的。之前研究表明miR-330-5p可以抑制胰腺癌细胞MUC1表达,并且下调结肠直肠癌ITGA5表达。而且miR-326可以通过下调癌基因CCND1抑制NSCLC的恶性表型变化。根据TarBase数据库,miR-330-5p and miR-326或可直接结合FASN基因,该基因是各种癌中一个代谢相关基因。而且,通过分析TCGA数据和在线芯片数据,我们确信肺癌高FASN与差的预后相关。因此,我们的发现支持一个假设,即circFARSA可以通过海绵吸附miR-330-5p/miR-326,减少对癌基因FASN抑制,进而促进肺癌发展。
本研究有几点意义。第一,使用RNAseq技术揭示了NSCLC circRNAs的整体差异表达情况。第二,第一次尝试研究NSCLC病人,血浆circRNAs作为分子标志物。我们发现线虫circRNA,cel_9在人血浆中可以稳定存在,并适合作为内参。最后,生信分析及体外实验均显示circFARSA在肺癌进展中极为重要。然而,本研究也有几点限制。首先,虽然采用两步实验,对 circRNAs进行筛选和验证,但样本量还是较少。其他circRNAs仍可能作为肺癌的分子标志物,后续研究需要更大样本量的circRNAs筛选和血浆验证。第二,需要做更多的功能实验以研究NSCLC病人中circFARSA–miRNA–FASN关系。
总结,本研究通过一系列证据证明血浆circFARSA可以作为NSCLC新的分子标志物。我们的研究也给以后研究循环circRNAs作为癌非侵入性分子标志物提供了一个参考。
5 研究思路
实验材料:
10对NSCLC病人癌与癌旁组织,50例NSCLC病人血浆,50例健康人血浆,TCGA数据库,已发表血清circRNAs表达谱数据。
研究过程:
1 10对癌与癌旁样品,RNAseq,去rRNA建库,未去除线性RNA。CIRCexplorer鉴定并定量circRNAs,DESeq2进行差异分析,fc >2 and P < 0.05认为有差异(为什么不是q< 0.05?)。
2 整合本数据与已发表的血清circRNAs表达谱挑选10个circRNAs,并在10个病人中进行初步验证。
3 对circFARSA扩大到50对样品中进行验证。
4 过表达circFARSA,观察肺癌细胞增殖,迁移,侵袭情况。
5 Circular RNA Interactome,DIANA-TarBas ev.7.0,TarBase 构建circFARSA-miRNA-mRNA调控网络。
结果展示:
1 circRNA表达谱描述
火山图(Fig. 1A),circRNAs在染色体上分布柱状图(Fig. 1B),差异表达circRNAs热图(Fig. 1C)。
2 qPCR验证
10例病人9个circRNAs qPCR验证柱状图(Fig. 2A),circFARSA和cel_9是否特异性扩增熔解曲线(Fig. S2),Sanger测序验证circFARSA成环(Fig. S3)。
3 血浆circFARSA验证
circFARSA 50对血浆中检测(Fig. 2C),血浆circFARSA表达量与病人临床特征的关系(Table S4),ROC曲线(Fig. 2D)。
4 circFARSA表型功能
细胞增殖曲线图(Fig. S5),迁移和侵袭(Fig. 3),
5 circFARSA调控的miRNA–mRNA通路
KEGG通路柱状图(Fig. 4A),circRNA–microRNA–mRNA网络图(Fig. 4B)。FASN在肺腺癌中表达量(Fig. S6A),FASN与预后的关系Kaplan–Meier曲线(Fig. S6B)。





可以收藏吗?
评论过的,查看以往评论过的文章就可以看到了