原创作者:shenlize|联川生物
本期专题将围绕CircRNA的鉴定技术和CircRNA后期验证展开,主要内容有qRT-PCR定量验证CircRNA、Northern blot验证CircRNA、过表达验证CircRNA、RNA验证CircRNA、荧光原位杂交定位CircRNA、荧光素酶报告基因检测CircRNA、CircRNA翻译功能验证等,精不精彩?还等什么,快来和小编一起开启学习模式吧~
CircRNA鉴定技术
CircRNA的生物信息分析鉴定目前采用CIRCExplore软件,分析流程可以分为三步(见图1)。
Step1:测序后的Reads经过TopHat比对之后,把没有比对上基因组的Reads用TopHat-Fusion和注释的back-spliced junctions位点序列进行比对。由于某些外显子末端的序列比较相似,因此会导致比对后的junction reads在错误的位置被分开,最后比对到错误的位点(红色的bar)。
Step2:对junction reads进行重新排列,用自定义的算法对上一步的错误比对进行校正。
Step3:结合预测的back-spliced exons(蓝色的bar)和预测的junction reads对CircRNA进行注释。
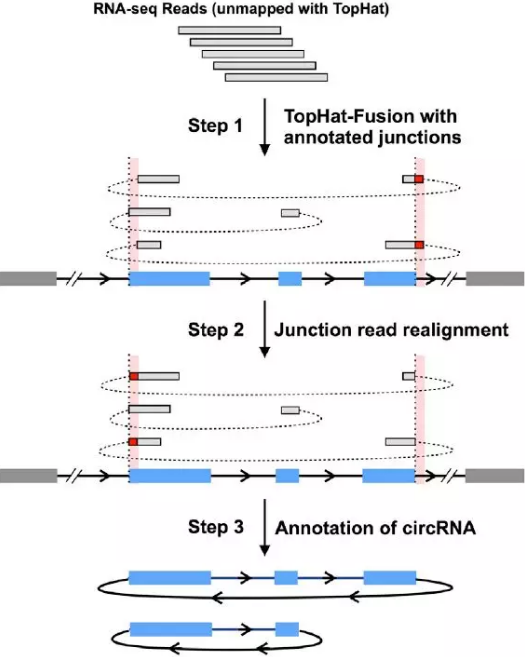
图1 CircRNA鉴定技术流程
CircRNA后期验证
通过二代测序和生物信息分析鉴定出来的CircRNA,后期需要通过实验进一步验证CircRNA的存在及其生物学功能。目前CircRNA的验证方法主要有以下几种:
(1)qRT-PCR定量验证CircRNA
CircRNA定量验证主要通过分离得到非多聚腺苷酸化RNA或去rRNA后 的RNA、用RNase R去除线性RNA、随机引物反转录成cDNA、RT-PCR扩增、PCR产物跑胶验证、PCR产物测序验证等技术手段,其中最关键的步骤是针对CircRNA设计特异性的RT-PCR引物。CircRNA的环化方式有两种:内含子环化(ciRNA)和外显子环化(CircRNA),通过外显子环化产生的CircRNA除了back-spliced junction位点处与线性RNA不同外,其他区域是一致的,因此可以针对CircRNA的back-spliced junction位点设计特异性的引物(divergent primers)(见图2),divergent primers可以通过网站直接进行设计。
http://circinteractome.irp.nia.nih.gov/Divergent_Primers/divergent_primers.html
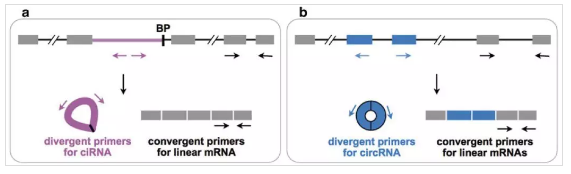
图2 CircRNA定量验证引物设计示意图
(2)Northern blot验证CircRNA
Northern blot验证CircRNA主要通过分离得到非多聚腺苷酸化RNA或去rRNA后的RNA、用RNase R去除线性RNA、变性聚丙烯酰胺凝胶电泳(PAGE)等技术手段来验证。其中根据CircRNA环化的方式设定探针序列是至关重要的步骤。对于内含子环化产生的ciRNA,可以根据内含子序列设计探针(图3 a);对于外显子环化产生的CircRNA,尽可能跨越backsplice junction位点设计探针(图3 b)。验证策略是对基因组DNA、总RNA以及CircRNA(DNA free、rRNA free、linearRNA free)同时进行杂交验证。
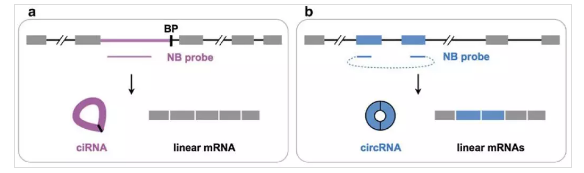
图3 Northern blot探针设计示意图
(3)过表达验证CircRNA
CircRNA的成环机制有很多,其中基于CircRNA侧翼的反向互补序列(Alu序列)是目前公认的一种成环机制。因此我们可以通过PCR扩增目标区域(包含CircRNA侧翼的Alu元件或者内部的碱基互补序列)、根据限制性酶切位点进行酶切并连接到载体上;过表达载体转染;定量PCR检测转染效率;divergent primers鉴定CircRNA过表达倍数等技术手段验证CircRNA。过表达策略:
1. 扩增目标区域包含circRNA侧翼Alu序列或内部碱基互补序列,侧翼上下游1kb处过表达效率更佳;
2. 目标区域扩增基于基因组DNA为模版。
(4)RNA验证CircRNA
和过表达策略相反,我们可以采用RNA干扰技术验证CircRNA。对于内含子环化产生的ciRNA,可以根据内含子序列设计相应的siRNA进行干扰,对于外显子环化产生的CircRNA,可以根据backsplice junction位点处序列信息设计siRNA,最后通过divergent primers鉴定CircRNA敲除倍数。验证策略:可以同时设计三种siRNA,一种是和CircRNA backsplice junction位点靶标结合的siRNA,可以特异性干扰CircRNA的表达;一种是和linear RNA靶标结合的siRNA,可以特异性干扰linear RNA的表达;还有一种是和CircRNA、linear RNA共有的外显子序列结合的siRNA,可以同时干扰CircRNA和linear RNA的表达。
(5)荧光原位杂交定位CircRNA
位于细胞核中的ciRNAs主要调控亲本基因的表达,而位于细胞质中的CircRNA主要发挥竞争性内源RNA(ceRNAs)的作用,一般采用荧光原位杂交技术(FISH)对CircRNA进行定位,以便于后续功能的进一步研究,设计的杂交探针需要跨越backsplice junction位点。
(6)荧光素酶报告基因检测CircRNA
报告基因表达系统是将报告基因的编码序列与目的基因相结合,将结合基因进行表达,通过检测报告基因的表达产物来测定目的基因的表达量。荧光素酶报告基因系统是以荧光素为底物通过荧光测定仪检测生物荧光进而检测荧光素酶的活性,荧光素和荧光素酶这一生物发光体系,可以极其灵敏、高效地检测基因的表达。
(7)CircRNA翻译功能验证
CircRNA包含核糖体进入位点,可以翻译表达有效蛋白是最近研究的热点,circRNA翻译功能的验证可以通过NGS和生物信息学方法(翻译组学)对ORF进行预测;外源性功能验证可以通过人工合成小circRNA或者是荧光报告基因对circRNA进行验证;内源性功能验证可以通过Minigene表达载体、蔗糖密度梯度实验、质谱鉴定等方法对circRNA进行验证。其中Minigene表达载体包含circRNA的表达框:外显子侧翼的反向互补序列以及促使环化剪切的介导序列。Minigene表达载体转染到细胞中可以主动成环,因此是内源性的circRNA的模拟物,转染后可以通过定量PCR检测转染效率,divergent primers鉴定CircRNA表达量。
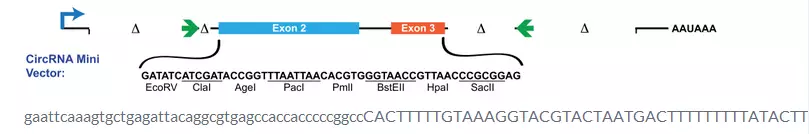
图4 circRNA Mini表达载体结构
参考文献
1. Ashwal-Fluss R, Meyer M, Pamudurti N R, et al. circRNA Biogenesis Competes with Pre-mRNA Splicing[J]. Molecular Cell, 2014, 56(1):55-66.
2. Chen L L. The biogenesis and emerging roles of circular RNAs[J]. Nature Reviews Molecular Cell Biology, 2016, 17(4):205.
3. Chen L L, Yang L. Regulation of circRNA biogenesis[J]. Rna Biology, 2015, 12(4):381.
4. Jeck W R, Sorrentino J A, Wang K, et al. Circular RNAs are abundant, conserved, and associated with ALU repeats[J]. Rna-a Publication of the Rna Society, 2013, 19(2):141-157.
5. Legnini I, Timoteo G D, Rossi F, et al. Circ-ZNF609 Is a Circular RNA that Can Be Translated and Functions in Myogenesis[J]. Molecular Cell, 2017, 66:22–37.e9.
6. Panda A C, Abdelmohsen K, Gorospe M. RT-qPCR Detection of Senescence-Associated Circular RNAs[M]// Oncogene-Induced Senescence. Springer New York, 2017.
7. Pamudurti N R, Bartok O, Jens M, et al. Translation of CircRNAs.[J]. 2017.
8. Zhang X O, Wang H B, Zhang Y, et al. Complementary Sequence-Mediated Exon
Circularization[J]. Cell, 2014, 159(1):134.
9. Zhang Y, Yang L, Chen L L. Characterization of Circular RNAs[J]. Methods in
Molecular Biology, 2016, 1402(1):215.
10. Zhang Y, Zhang X O, Chen T, et al. Circular Intronic Long Noncoding RNAs[J]. Molecular Cell, 2013, 51(6):792–806.





来第一个抢占沙发评论吧!